会议回顾
2024年3月29日,中山大学孙逸仙纪念医院黄林副研究员邀请了潘滔教授进行了线上学术报告“ 利用新工具解码和研究表观转录组”。潘滔教授是芝加哥大学生物化学与分子生物学教授,主要研究兴趣为表观转录组学、功能基因组学、微生物组学、RNA修饰和tRNA等。1990年取得耶鲁大学博士学位、在1994年成为癌症研究基金会Raymond F.Zelko青年研究员、2015年成为美国科学促进会(AAAS)研究员,获得Damon Runyon-WalterWinchell 癌症研究基金、美国癌症协会初级教师研究奖、美国国立卫生研究院EUREKA奖、美国国立卫生研究院院长先锋奖等多项基金及荣誉。
会议内容
表观转录组学是指细胞RNA中的化学修饰变化,其中包括许多具有不同化学计量和功能的化学修饰类型。人类RNA在tRNA中含有大约40种修饰类型,在mRNA中含有大约10种修饰类型。潘滔教授将讲述他实验室中利用纳米孔测序进行mRNA修饰检测和iumina测序进行tRNA修饰检测的最新技术发展和生物学研究。
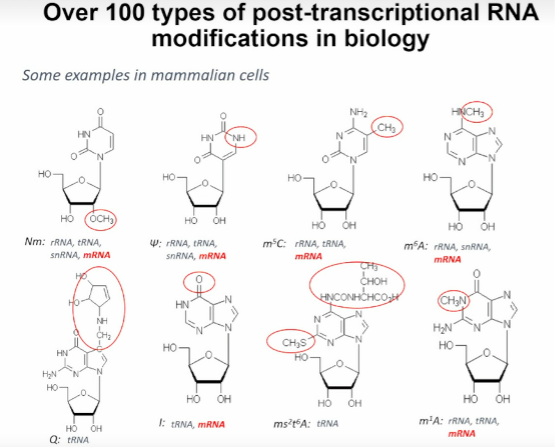
图1. 生物学中的 100 多种转录后 RNA 修饰
在人类细胞中,已经发现了大约50种不同类型的化学修饰,其中大约有40种出现在tRNA中;10种出现在mRNA中。这些修饰涉及到从简单的甲基化到复杂的环结构构建等各种各样的化学结构。例如,2'-O甲基化、伪尿嘧啶、5-甲基胞嘧啶等。此外,还有一些其他类型的修饰,比如伪尿嘧啶、鸟嘌呤、N6-二甲基腺嘌呤等等,这些修饰在RNA转录中发挥着重要的作用。细胞的修饰对于调控基因表达和维持细胞功能至关重要,而潘教授的研究旨在深入了解这些修饰的功能和机制。
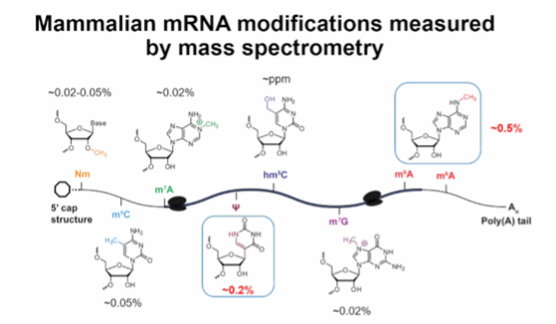
图2. 用质谱法测量哺乳动物 mRNA 的修饰情况
潘教授课题组使用质谱技术来分析这些修饰的丰度,其中甲基化修饰和伪尿嘧啶修饰是最常见的两种,其丰度占据了RNA转录中的主要比例。除此之外,还有一些其他的修饰,虽然出现频率较低,但同样在调控基因表达和细胞功能中发挥着重要作用。RNA修饰的功能和调控机制。在这方面,他们着重探讨了修饰酶、清除酶和读取蛋白之间的相互作用,以及它们如何影响RNA的结构和功能。他们发现,修饰的丰度和分布模式与细胞功能和表型密切相关,这为进一步理解细胞过程提供了重要线索。
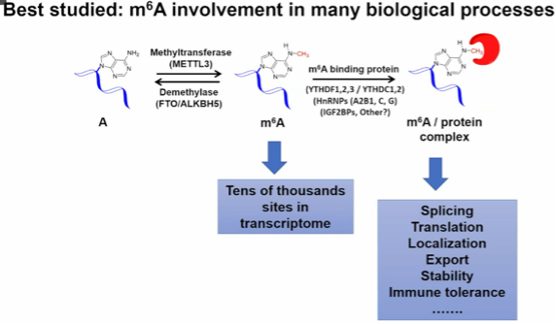
图3. m6A修饰参与许多生物过程
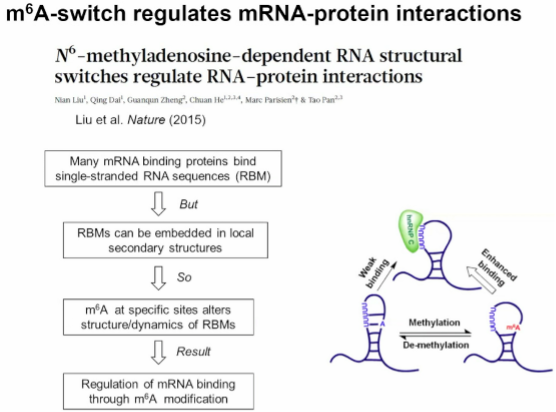
图4. m^6A 开关调节 mRNA 与蛋白质之间的相互作用
潘教授课题组发现m6A RNA修饰可以改变RNA的局部二级结构,从而影响RNA与蛋白质的相互作用,进而调节基因表达和细胞功能。还发现了一些新的RNA读取蛋白RBMs,它们通过影响RNA的结构来识别修饰位点。这些发现为深入理解RNA修饰的功能和机制提供了新的视角,并为相关疾病的治疗提供了新的思路。
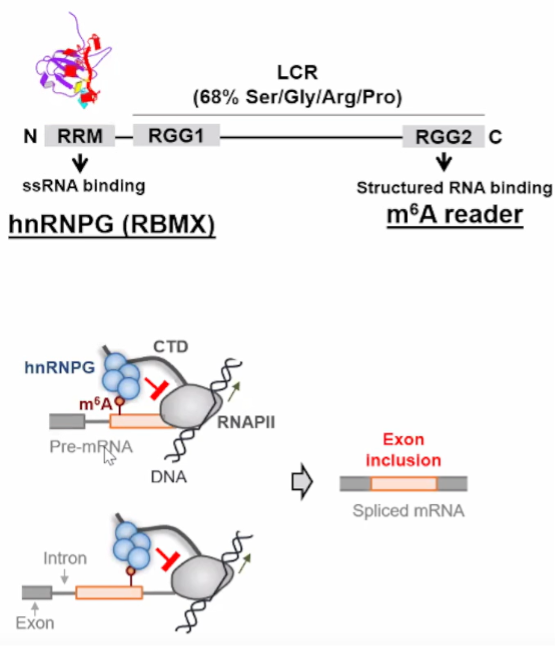
图5. m^6A修饰影响RNA结构的实验
潘教授课题组发现m6A修饰可以改变RNA的局部二级结构,从而影响RNA与蛋白质的相互作用,举例说明了这一机制。研究了另一种读取蛋白质RBMX与m6A修饰之间的关系,发现该蛋白质通过影响RNA结构来读取修饰。实验展示了m6A修饰如何通过影响RNA结构从而影响蛋白质与RNA的相互作用。
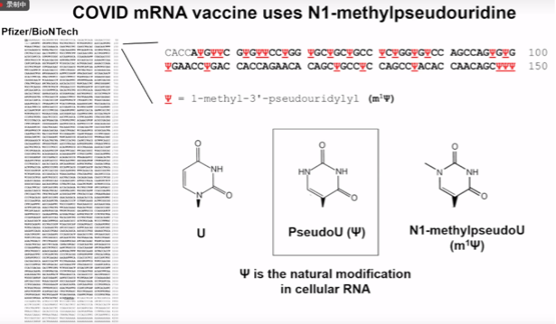
图6. COVID mRNA 疫苗使用 N1-甲基假尿嘧啶
潘教授课题组除了探索RNA修饰的功能外,他们还对一种称为Pseudo Uridine的修饰进行了深入研究。这种修饰被发现可以阻止免疫系统的感应,并提高细胞的产量。通过对Pseudo Uridine的研究,他们展示了如何利用RNA修饰来调节细胞过程,为未来的研究提供了新的方向。研究人员通过替代基因中的尿苷(uridine)为假尿苷(pseudouridine),开展了对RNA修饰的深入研究。尽管假尿苷不是天然存在于人类细胞中的修饰,但在一些组织和受到压力的细胞中也能发现其存在。假尿苷的引入可以降低免疫系统的响应,增强翻译过程的稳定性,从而提高蛋白质的产量。

图7. 使用 rRNA 中的Ψ 作为训练数据:相同混合物的 NGS 和 nanopore
潘教授课题组开发了一个新技术-纳米孔测序技术,其工作原理是:即通过在蛋白孔中引入核酸,当核酸通过孔道时,会部分阻塞电流,从而产生电流变化,从而实现对核酸的测序。传统的NGS方法对于伪尿苷修饰的测序结果常常存在错误,因此转而使用纳米孔测序技术。潘教授强调了建立良好的训练数据和机器学习模型的重要性,并分享了他们使用微生物组样品进行训练的方法,以获得更多有效的数据。潘教授介绍了如何从训练数据中提取特征并建立机器学习模型,并讨论了纳米孔测序软件提供的一些特征,如插入频率、缺失频率和突变率等。最后,潘教授课题组总结了他们的研究方法,强调了纳米孔测序技术在研究RNA修饰方面的潜力。
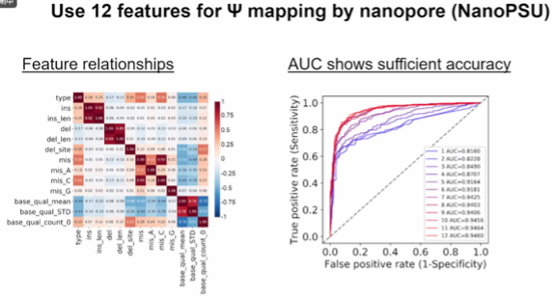
图8. 利用纳米孔(NanoPSU)的 12 个特征进行 Ψ 图谱绘制
p潘教授课题组使用纳米孔测序技术研究了伪尿苷修饰,并通过机器学习建立了伪尿苷修饰的预测模型。他们利用软件提取了每个核苷酸的十二个特征,并通过训练数据确定了伪尿苷修饰的特征模式。通过绘制ROC曲线评估模型的准确性,发现该模型在加入更多特征后准确率逐渐提高,最终达到了0.94的水平。
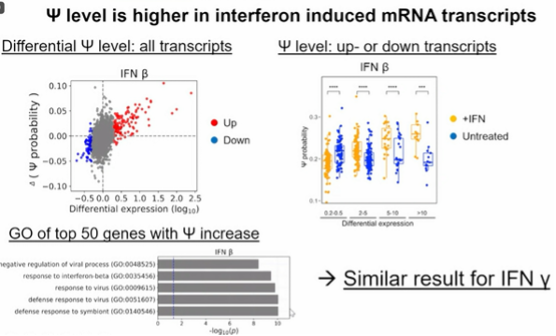
图9. 干扰素诱导的 mRNA 转录本中的Ψ 水平较高
此外,潘教授课题组还研究了干扰素对伪尿苷修饰的影响,发现干扰素可以显著提高细胞中伪尿苷修饰的含量。他们使用基因表达水平的变化来评估伪尿苷修饰的变化情况,发现在受到干扰素诱导的条件下,伪尿苷修饰的含量普遍增加。总的来说,潘教授课题组的研究揭示了伪尿苷修饰与干扰素响应之间的关系,为深入理解RNA修饰在细胞过程中的作用提供了新的线索。作者利用先进的测序技术进行研究,以了解干扰素对基因表达的影响以及RNA修饰的变化。通过nanopersequencing技术,他们能够在单个转录本水平上测量伪尿嘧啶(pseudo U)修饰的程度,而不是传统上关注具体的修饰位点。这种方法使他们能够更全面地了解RNA修饰的整体变化,而不是局限于特定位点的观察。
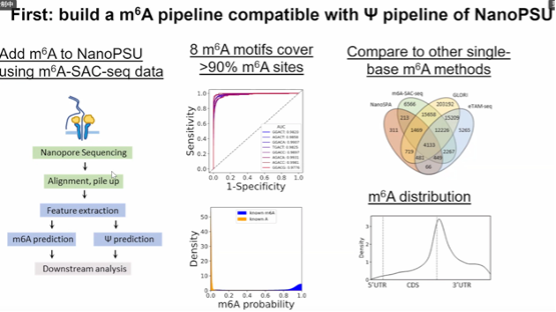
图10. 建立与 NanoPSU 的Ψ 管道兼容的 m6A 管道
N6-甲基腺苷(m6A)和假尿苷(Ψ)是哺乳动物信使 RNA 中最丰富的两种修饰,但人们对它们的生物功能的协调性仍然知之甚少。潘教授课题组开发了一种基于机器学习的纳米孔直接 RNA 测序方法(NanoSPA),可同时分析人类转录组中的 m6A 和 Ψ。将 NanoSPA 应用于多聚体分析,我们发现了 m6A 和 Ψ 在转录组中的对立共存以及 m6A 和 Ψ 对多聚体的协同分层效应。
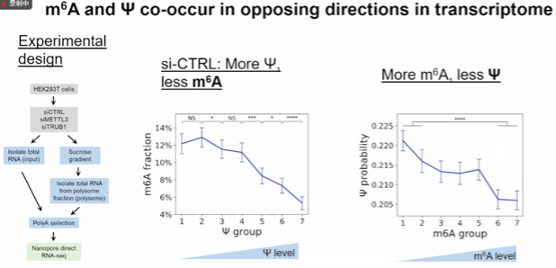
图11. m^6A 和 Ψ在转录组中以相反的方向共存
NanoSPA,可同时分析人类转录组中的m6A和Ψ,并利用高质量的训练数据集为m6A创建了模型,这为m6A预测提供了可靠的基础。通过实验,研究发现m6A和Ψ在转录本中呈现相互排斥的关系,m6A和Ψ的数量呈负相关,这为进一步探究这两种修饰的相互作用提供了线索。NanoSPA在m6A预测方面表现出色,其准确性和覆盖率较高,与其他方法相比具有显著优势,这为m6A研究提供了一种有效的工具。填补了两者在同一mRNA分子内相互作用的机理研究的空白,揭示了m6A和假尿苷修饰在转录翻译过程中的协同作用。
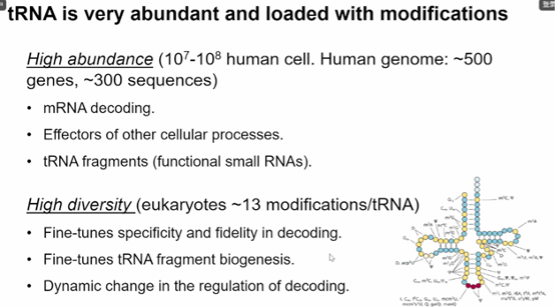
图12. tRNA 非常丰富,含有大量修饰成分
tRNAs是丰富的小非编码RNAs,在蛋白质翻译中起着核心作用。为了桥接RNA和蛋白密码子,tRNA被广泛修饰,平均每个tRNA分子含13个修饰。少数tRNA修饰是结构性和静态的,但其他修饰是动态甚至可逆的,影响着单个tRNA分子的命运和功能。tRNA修饰酶的突变与多种人类疾病有关,在正常细胞功能中扮演重要角色。但目前缺乏一种简单、稳健和高效的tRNA测序方法来系统地准确定量tRNA丰度及其修饰。
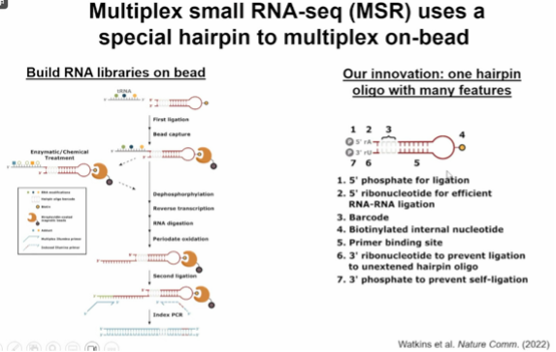
图13. 多重小 RNA-seg(MSR)使用特殊发夹在试剂盒上进行多重分析
潘教授课题组介绍了一种多重小 RNA 测序(MSR-seq)平台,该平台旨在通过分析小 RNA 及其修饰来加深对细胞应激反应的理解。MSR-seq 方法可以研究小 RNA(包括 tRNA、snRNA、micro-RNA 和 tRNA 片段)对各种应激(如热休克、过氧化氢和亚砷酸盐暴露)的细胞反应。这种方法的显著特点是能够深入了解小 RNA 对细胞应激的协调反应,而这正是常用的小 RNA 序列分析策略所面临的挑战。MSR-seq平台设计用于在beads(磁珠)上构建RNA文库,并使用一种特殊的发夹形结构寡核苷酸进行多路复用。该平台有以下创新点:①首端磷酸化,为连接效率提供便利。②5'末端的核糖核苷酸可提高一级连接的效率。
使用条形码进行样本池化和多路复用。③生物素标记的内部核苷酸用于固定化。④发夹中嵌入的引物结合位点用于逆转录和PCR。⑤3'末端的核糖核苷酸用于⑥防止自由CHO(未连接的发夹寡核苷酸)的二级连接。⑦3'末端的磷酸盐用于防止CHO的自我连接。
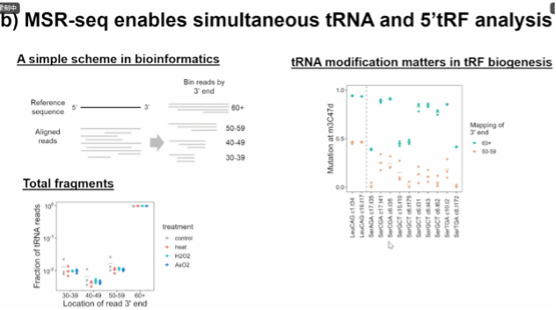
图14. MSR-seg 可同时进行 tRNA 和 5'tRF 分析
MSR-seq平台允许同时进行tRNA和5'tRF(tRNA片段)分析。分析的简化方案在生物信息学中将reads按其3'末端分箱。图中展示了总片段中tRNA的比例,并通过tRNA的修饰表明tRF生物生成过程中tRNA修饰的重要性。总之,MSR-seq是一个在固定支持上进行RNA文库构建的平台,允许多路复用,同时可以进行酶处理和化学处理。这为tRNA的综合分析提供了一种强大的方法,特别是在考虑到它们在细胞应激响应中的作用时。通过MSR-seq,可以在相同的反应中研究多个RNA样品,提高了实验的通量和效率,并减少了样品制备的复杂性。
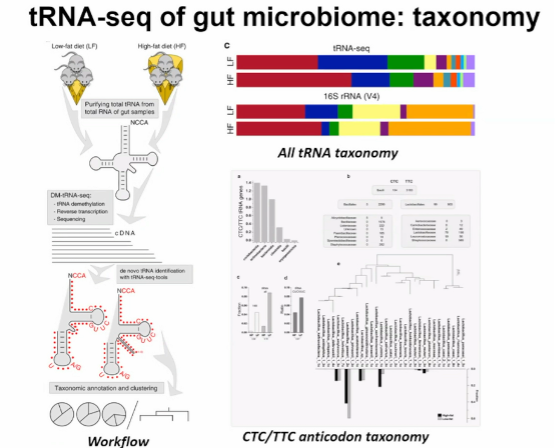
图15. 肠道微生物群的 tRNA-seg:分类学
潘教授课题组还开发了一套软件tRNA-seq-tools。将tRNA-seq用来推断微生物群落结构和分类学,在样本中使用tRNA序列进行调查,研究不同环境条件下不同反密码子的tRNA表达,并且恢复不同分类的tRNA修饰水平。通过tRNA-seq,研究者能够基于tRNA序列推断样本中的微生物群落结构和分类学,这与传统的16S rRNA基因扩增子分析相比较,可以提供额外的生理状态信息。总的来说,tRNA-seq被用来推断微生物群落结构和分类学,在样本中使用tRNA序列进行调查,研究不同环境条件下不同反密码子的tRNA表达,并且恢复不同分类的tRNA修饰水平。
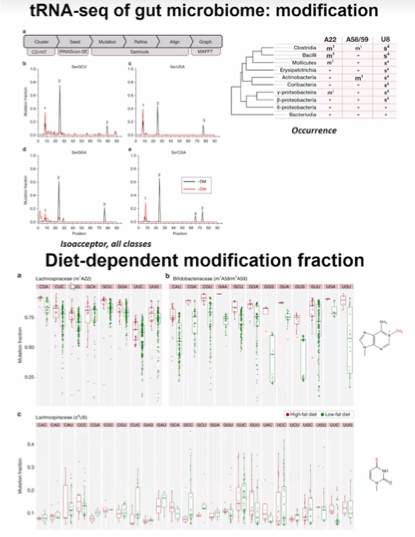
图16. 肠道微生物群的 tRNA-seg:修饰和饮食依赖性修饰分数
利用tRNA-seq数据,能够识别tRNA修饰,并研究这些修饰在微生物应对环境变化时的代谢活动变化。例如,可以鉴定出tRNA修饰的变化,从而揭示出不同饮食条件下微生物tRNA修饰的分类学依赖变化。
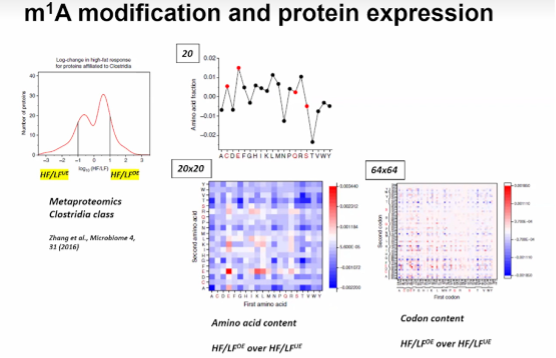
图17. m^1A 修饰和蛋白质表达
tRNA-seq不仅能够检测微生物群落中的tRNA丰度,还能够通过测序未经脱甲基处理的样本来分析tRNA修饰,进而反映翻译活动。
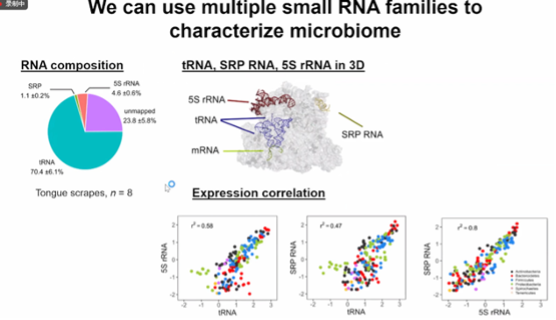
图18. 多个小型RNA家族来表征微生物组
图中展示了不同类型的RNA之间的表达水平呈现一定的相关性,从而可以通过表达水平的比较,进一步推断微生物组的功能状态。能够通过分析不同小型RNA家族在样本中的比例和表达关联性,能够更全面地了解微生物组的组成和可能的生理状态。这种多维度的分析可能有助于发现微生物组在健康和疾病状态下的功能变化。
潘滔教授此次会议报告已收录于Guangzhou RNA club bilibili视频网站(https://www.bilibili.com/video/BV1dH4y1H7FM/?spm_id_from=333.999.0.0)
欢迎关注Guangzhou RNA club公众号、网站(rnaclub.rnacentre.org)、twitter(@RNA_club)。

















