会议回顾
2024年1月10,刘默芳教授进行了线上学术报告“RNA调控与雄性生殖发育”。刘默芳,中科院分子细胞科学卓越创新中心/生化细胞所研究员、PI;国家杰青、“万人计划”领军人才和新基石研究员获得者。主要从事RNA调控与雄性生殖研究,面向国际前沿和人口健康,针对精子发生极其复杂并有许多未解之谜、男性不育一半以上病因不明并已成为全球性社会问题等,聚焦RNA调控与精子发生和男性不育,获得了系列原创重大研究成果,包括首次证明piRNA调控通路异常是男性不育新病因、揭示了精子细胞mRNA翻译调控和清除降解新机制等,解答了精子发生中多个未解之谜,提出了新的理论,提升了对雄性生殖规律和男性不育病因的认识;发表学术论文80多篇,包括以通讯作者在Science、Cell (2篇)、New Engl J Med、Nat Cell Biol、Mol Cell、Dev Cell 等的30多篇;成果入选“国家重点研发计划重大科技成果”、“中国生命科学十大进展” 、“中科院科技亮点成果(2次)等;作为RNA调控与生殖领域主要引领者之一,近期受邀Nat Rev Mol Cell Biol长文综述,系统总结了Piwi/piRNA研究进展。担任《中国科学:生命科学》副主编、RNA专业委员会主任、科技部重点研发计划和上海市重大基础研究项目等项目首席科学家,获上海市自然科学一等奖、全国妇幼健康科学技术奖自然科学一等奖、谈家桢生命科学创新奖等荣誉。
会议内容
刘默芳教授以近年来,中国新生人口数呈断崖式下降,其中人类生育力下降是重要原因,特别是男性不育的问题为背景,引入了精子发生的概念。精子发生是指精子在睾丸的曲细精管(seminiferous tubules)中产生,是一个非常复杂且独特的细胞分化和发育的过程,起始于生精干细胞,经历有丝分裂、减数分裂、精子形成这三个阶段,才能形成高度特化的精细胞。精子发生过程中的基因表达调控,也十分独特,期间要经历两次转录高峰,以及随之而来的大量RNA加工储存、翻译、降解等RNA水平的调控事件。因此RNA调控在精子发生过程中,是至关重要的。
在人类基因组中编码的约2000个RNA结合蛋白就有1500个在睾丸组织中,它们都是特异性表达或者高表达,另外种类繁多的非编码调控RNA在睾丸组织中也是特异性表达或者高表达。这些说明了RNA调控在精子发生过程中十分重要。那么RNA调控是如何在精子发生过程中发挥作用的呢?该报告就主要介绍刘默芳教授团队在男性不育相关piRNA调控通路基因突变的发现及精子细胞中的翻译调控研究。
刘默芳教授的实验室研究的Piwi家族蛋白以及与它相互作用的小RNA—piRNA,就是典型的生殖细胞中特异性表达的RNA结合蛋白以及非编码调控RNA。小鼠的三个Piwi蛋白成员在精子发生过程中呈现时空特异性表达(小鼠基因组编码三种Piwi旁系同源物,Miwi、Mili和Miwi2,它们都在睾丸中高度表达,因此,所有这些都是雄性而非雌性生育所必需的)。任意一个Piwi基因的敲除都会导致小鼠出现完全的雄性不育,但是对于Piwi蛋白基因敲除导致雄性不育的机制了解是来源于2006年,有研究者发现Piwi蛋白与一类新的生殖细胞特异性小非编码RNA相关,称为Piwi相互作用RNA(piRNA),这激发了人们对Piwi蛋白的兴趣。Piwi蛋白与piRNA形成复合物,相互作用的机制已被充分证明可以通过沉默动物生殖细胞中的转座子来保持基因组完整性。这是Piwi蛋白与piRNA这个通路的一个经典功能。然而在此之前,还没有有研究报道过对于Piwi蛋白和piRNA功能调控异常,是否与男性不育有相关性。
Piwi蛋白由四个不同的结构域组成:N-末端、PAZ、MID和Piwi结构域。PAZ和MID结构域负责piRNA负载,而Piwi结构域类似于RNase H,但N-末端结构域的功能意义尚不清楚。 2013年刘默芳教授的实验室发现在脊椎动物Piwi蛋白的N端结构域中鉴定了一种保守的破坏盒(D-box),这是APC/C泛素E3连接酶底物共享的特征,包括小鼠的MIWI和人类的HIWI。在小鼠精子生成后期,MIWI以D-box依赖的方式被APC/C泛素化和降解。并进一步证明这种MIWI消除对于精子细胞正确转化为精子至关重要(图1)。
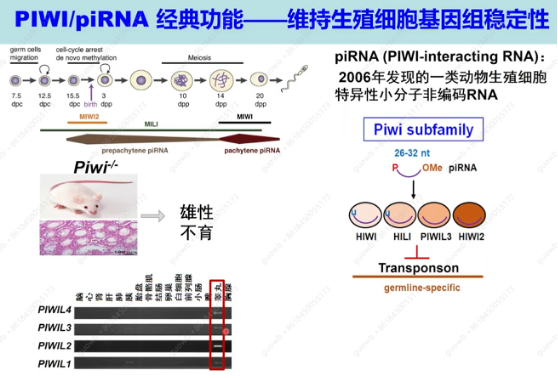
图1. PIWI/piRNA经典功能
由于怀疑HIWI D-box元件突变可能是导致人类男性不育的原因(人类基因组编码四个Piwi家族成员,包括Hiwi、Hili、Hiwi2和Piwil3,所有这些成员都主要在睾丸中表达),2017年刘默芳教授团队对413名特发性无精子症患者的HIWI基因第六和第七外显子的D-box区域进行测序,从而在三名无精子病患者中鉴定出特定的D-box突变。随后他们通过在敲除小鼠和转基因小鼠中模拟这种突变,证明了D-box突变阻碍了MIWI的降解并导致小鼠完全雄性不育,从机制上来说是雄性小鼠中的MIWI D-box突变损害了精子发生过程中的组蛋白泛素化和组蛋白到精蛋白的转变,即MIWI D-box突变导致Piwi蛋白在后期精子细胞中异常稳定,从而导致与它相互作用的组蛋白泛蛋白连接酶RNF8被扣留在细胞质中,因此在晚期精子细胞中RNF8不能核转位催化组蛋白泛素化修饰,以及组蛋白和精蛋白的交换,最终导致精子变形出现问题,使得突变小鼠只能产生少量的且功能异常的精子,以此导致小鼠雄性不育。另外刘默芳教授团队基于对此机制的了解,设计干预策略,可以成功的恢复突变小鼠精子活性,为这类男性患者的治疗提供了一种潜在的方法策略。
在后续的研究中发现,在200个患者中,有五个患者存在一种新的Piwi基因370位R-W的突变,这个突变位于Piwi蛋白中的一个特异性元件叫作PIWI-Ins,从结构解析方面把它称为PIWI insertion。对于这个基因的突变是否是治病性的突变呢?刘默芳教授团队通过突变小鼠的Piwi基因,即370位R-W,发现小鼠虽然没有出现完全的雄性不育,但却出现了小鼠雄性生育率低下的表现,证明了这种突变的确是潜在的治病突变。在体外通过构建小鼠缺失突变(敲除PIWI-Ins元件的9个氨基酸)发现,Piwi蛋白仍然具有加工和结合piRNA的能力,但与之结合的piRNA变短,之后又用涡虫PIWI-Ins元件的27个氨基酸代替小鼠PIWI-Ins元件的9个氨基酸构建了杂合的Piwi蛋白,而这个杂合的Piwi蛋白加工、结合piRNA更长,
证明了PIWI-Ins元件决定了MIWI结合piRNA的3’端和长度,为小鼠精子形成和雄性生殖必须; 在体内实验中,也将9个氨基酸的PIWI-Ins元件删除,发现突变小鼠是完全雄性不育,而且在附睾中没有精子,与体外实验一致,Piwi蛋白加工、结合的piRNA变短(图2)。为此刘默芳教授团队提出疑问,
PIWI-Ins突变以及变短的piRNA是如何影响精子形成呢?
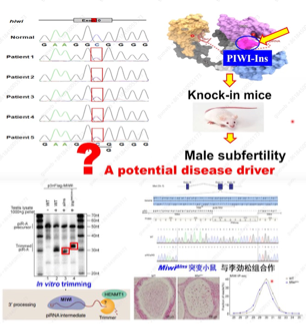
图2. 小鼠PIWI-Ins缺失突变
MiwiΔIns突变并不影响Piwi/piRNA 可以通过沉默动物生殖细胞中的转座子来保持基因组完整性这一功能(图3),他们发现Piwi/piRNA在小鼠精子细胞中对靶mRNA发挥双重调控作用,在早期球形精子细胞中参与mRNA的翻译激活,后期的精子细胞中,参与mRNA的清除降解。由于MiwiΔIns突变小鼠精子发生阻滞在第八步球形精子细胞期,而MIWI/piRNA在球形精子中激活翻译,因此
MiwiΔIns/shoter piRNA是否具有正常的翻译激活功能呢?
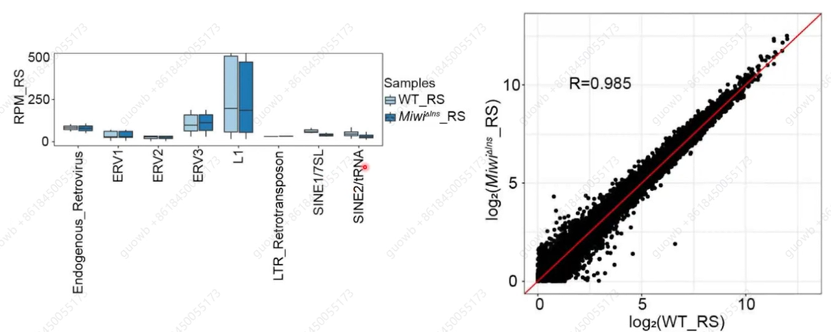
图3. 小鼠精子细胞转座元件活性及转录组
将野生型小鼠和MiwiΔIns突变小鼠的球形精子细胞分选出来,进行定量质谱分析,发现有900多个蛋白表达水平在MiwiΔIns突变的球形精子细胞来发生了变化,其中有37个蛋白表达呈现显著下降的状态,通过Western Blot 确认了对应的下降的37蛋白,其变化相当大,但在mRNA 水平上,变化并不是很大,以此证明这些蛋白下降的原因是翻译受损(图4)。
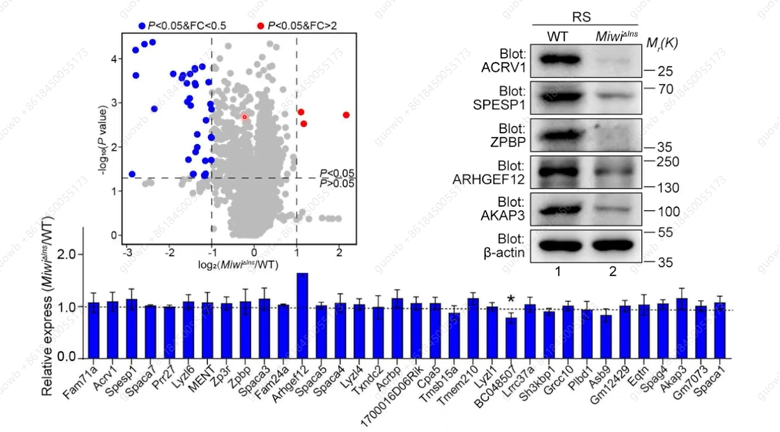
图4. MiwiΔIns突变小鼠蛋白表达的变化
为何MiwiΔIns/shoter piRNA的翻译功能会受损呢? 通过大量的细胞生物学实验和生化实验,发现是shoter piRNA使得翻译激活功能受损(图5)。从机制上讲,较长的piRNA为靶mRNA提供了额外的互补性,从而增强了用于翻译激活的MIWI/eIF3f/HuR超级复合物的组装。
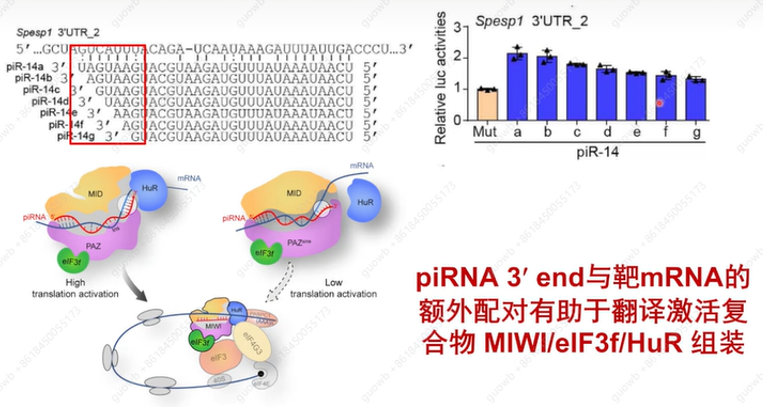
图5. MiwiΔIns/shoter piRNA的翻译功能变化
Ago蛋白家族可分为Piwi和Ago这两个蛋白亚家族,其中Ago参与结合siRNA和miRNA,长度为20-22nt;而Piwi结合的piRNA具有26-32nt。那么
为何Piwi蛋白能结合更长的小RNA?为何Piwi蛋白需要更长的小RNA呢?
Piwi蛋白结构中具有一个突起的插入元件,正好位于与之结合的小RNA的轨道中,从而使结合小RNA更长;而piRNA延申的3’端,赋予piRNA翻译激活功能(图6)。
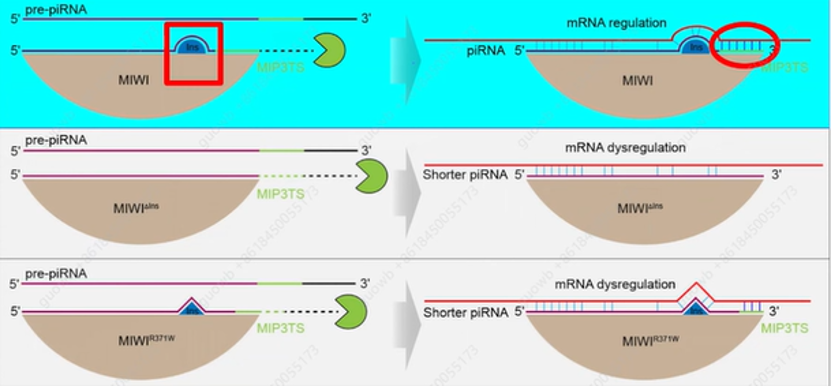
图6. Ago蛋白家族结合小RNA的长短变化
PIWIL1R370W突变是否影响MIWI结合piRNA长度? 通过构建了MiwiR370W突变小鼠发现,MiwiR370W的确可以影响结合piRNA长度,翻译程度有一定下降(比MiwiΔIns全部去除变化程度小)(图7)。表型分析发现这个MiwiR370W点突变小鼠并没有完全雄性不育,但生育力低下:产仔间隔期变长、育龄提前终止、精子数量和质量显著下调(图8),最终证明piRNA翻译激活作用受损影响男性生育力。
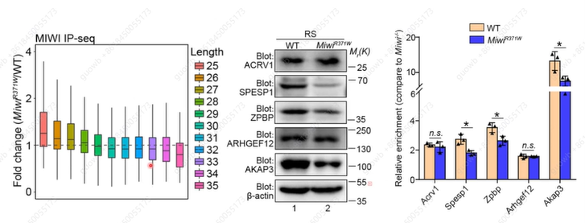
图7. MiwiR370W突变小鼠蛋白表达的变化
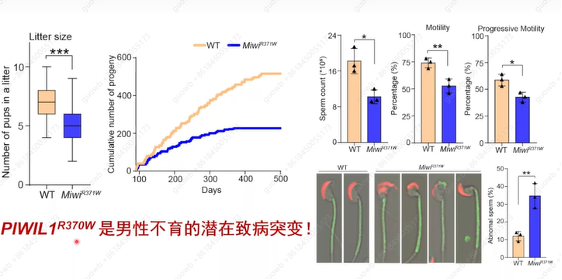
图8. MiwiR370W突变小鼠生育力的变化
piRNA加工酶PNLDC1基因突变致男性不育,从不育症患者中发现了47位的R-G的突变,同样通过建立突变小鼠模型,确认了这个突变将会导致小鼠完全雄性不育,且与患者表型一致(图9)。
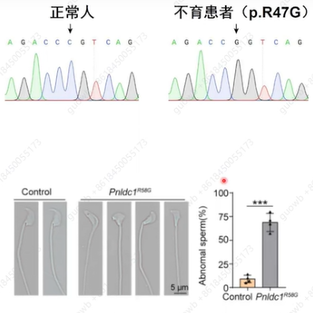
图9. piRNA加工酶PNLDC1基因突变
piRNA角度来解析男性不育,只是冰山一角,要深入系统性的去了解男性不育,我们必须要认识精子发生的规律,然后精子发生是动物体内最为复杂的发育事件,且目前为止精子发生仍然不能在体外完成,没有合适的研究系统,对于精子发生的分子基础,调控事件的了解非常有限,因此精子发生过程中尚有许多未解之谜。
刘默芳教授团队的研究主要集中在精子形成阶段,精子形成是一个连续细胞形态变化和染色质重构过程,期间与染色质结合的组蛋白,会被鱼精蛋白取代,导致精子细胞核的压缩与重构(图10)。
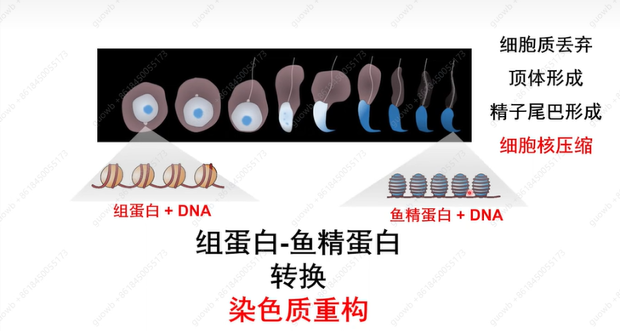
图10. 精子形成过程
组蛋白被鱼精蛋白取代以后,精子细胞中染色质的致密化,转录在精子发生过程中逐渐被抑制。因此,精子发生的程序依赖于早期转录的基因产物,并储存在翻译惰性的信使核糖核蛋白(mRNPs)中,直到特定的发育阶段,才会被翻译激活,生产出蛋白质,支持精子细胞的发育,这个现象叫作转录-翻译解偶联,即转录和翻译并不同步(图11),是精子发生过程中基因调控的一个独特特征,一直是理解生殖细胞发育程序的主要谜团之一。因而翻译调控成为精子细胞中主要的基因表达调控方式。
那么精子细胞中大量翻译抑制状态的mRNA是如何被激活的呢?
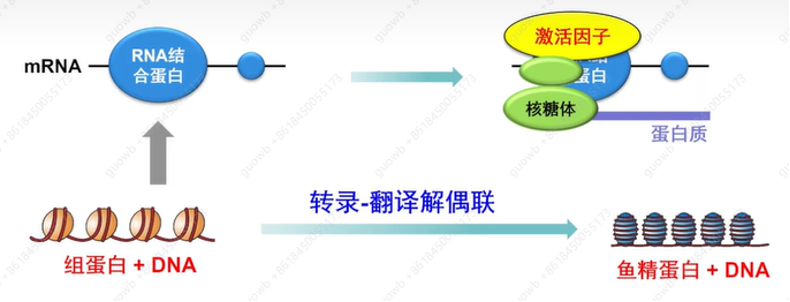
图11. 精子细胞转录和翻译过程
2019年刘默芳教授团队发现,MIWI /piRNA机制负责激活球形精子细胞中几百个mRNA的翻译,以配合精子的形态转化。这种作用需要piRNA与30个UTR中的靶mRNA的特异性碱基配对相互作用,这通过与顺式作用的富含AU的元件偶联来激活翻译,以发育阶段特异性的方式使MIWI/piRNA/eIF3f/HuR超复合体的形成成核(图12)。这些发现揭示了piRNA系统在翻译激活中的关键作用,对于健康精子的形成非常必要。
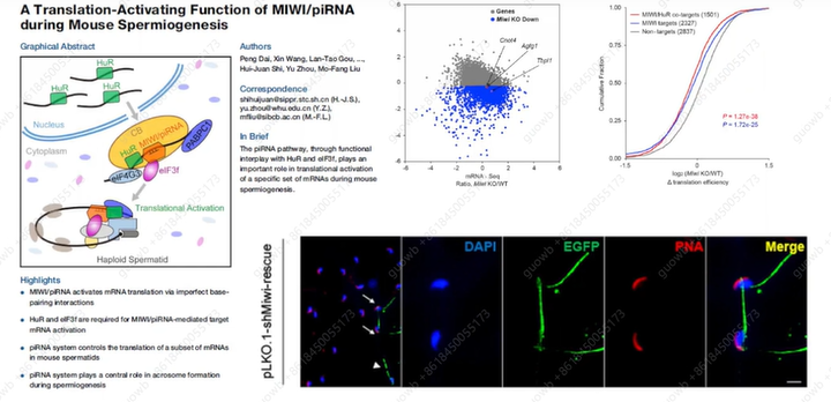
图12. MIWI /piRNA系统在翻译激活中的机制
刘默芳教授团队与杨建华老师团队合作完成的工作发现,在后期精子细胞中PIWI/piRNA与脱腺苷酸酶CAF1相互作用,诱导mRNA转录物的降解,因此在后期精子细胞中,PIWI/piRNA不再参与翻译的激活,即PIWI/piRNA机制也通过生殖细胞中的miRNA-和/或siRNA样机制介导mRNA转录物的降解。
那么后期精子细胞中的mRNA翻译如何激活呢?
为了了解翻译惰性mRNA在精子发生晚期是如何被激活的,刘默芳教授团队采用筛选策略,在小鼠晚期精子细胞(late spermatids,LS)中进行了定量蛋白质组学分析(图13),以确定在蛋白质合成中活跃的多聚核糖体(polysomes)中潜在的翻译调节因子。从两个发育时间点的小鼠睾丸中制备了多聚体组分:产后25天,其中含有圆形精子细胞(round spermatids,RS )但缺乏LS,以及35天,其中含有RS和LS 。发现35天的睾丸多聚体其中12种蛋白质相对于25天的显著升高。TARBP2是精子生成后期精蛋白mRNA的翻译激活剂,在35天睾丸多聚体中更富集,从而验证了这个筛选策略是正确的。
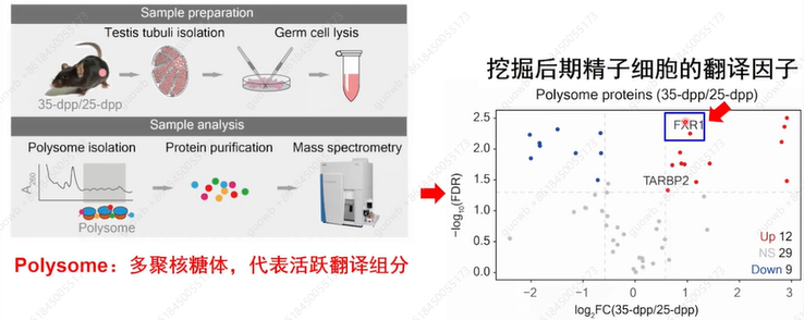
图13. 小鼠晚期精子细胞定量蛋白质组学分析
实验室将重点放在FXR1上,因为曾有研究记录了其副同源物FMR1/FMRP在调节翻译中的作用。FXR1属于脆性X相关(fragile X–related,FXR)家族,由FMR1/FMRP、FXR1和FXR2组成,它们是包含两个KH结构域和一个RGG盒的经典RBPs(图14)。FXR家族蛋白主要被证明是将靶mRNA转运到不同细胞内区室的翻译抑制剂。特别是,众所周知,FMR1/FMRP也会抑制突触的局部翻译,而这一关键翻译控制步骤中的缺陷是脆性X综合征的病理生理学原因。
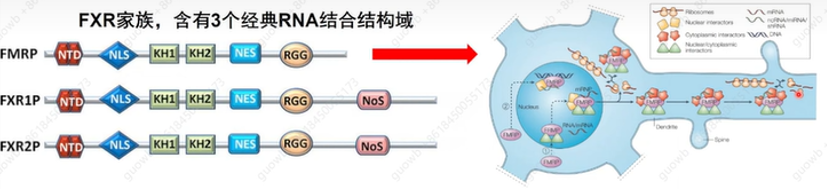
图14. FXR蛋白家族结构
FXR1蛋白在产后35天的小鼠的睾丸中的富集,因此假设FXR1参与了LS的翻译调控。研究结果也表示FXR1在成年小鼠睾丸中与多聚体的关系更为密切(图15):与成年小鼠的其他组织相比,FXR1在睾丸中的表达量要高得多,此外,FXR1在睾丸中的表达随着小鼠年龄的增长而增加, FXR1在LS中的表达量高于精母细胞(spermatocytes,SC)和RS 。接着利用eCLIP - seq鉴定了FXR1的靶mRNA,在35 天小鼠的睾丸中发现了4272个FXR1结合的mRNA;通过基因本体(Gene Ontology,GO)发现其在精子细胞分化和发育过程中特别富集,包括鞭毛形成、染色质重塑和精子运动(图16)。
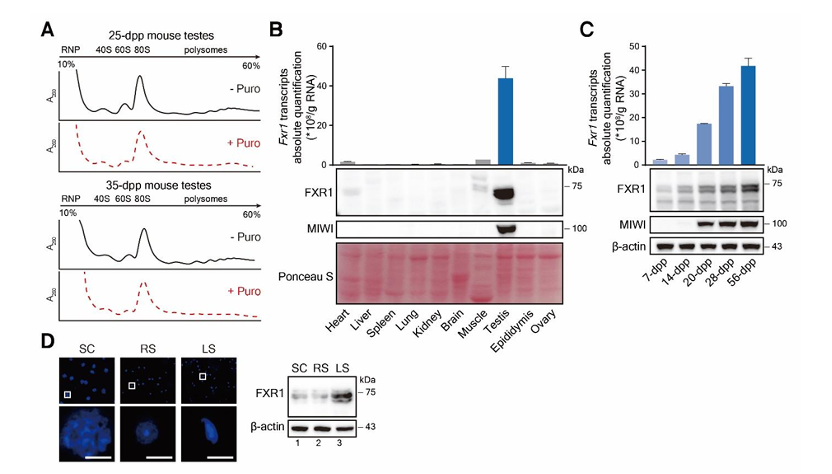
图15. FXR1在成年小鼠睾丸中高度表达
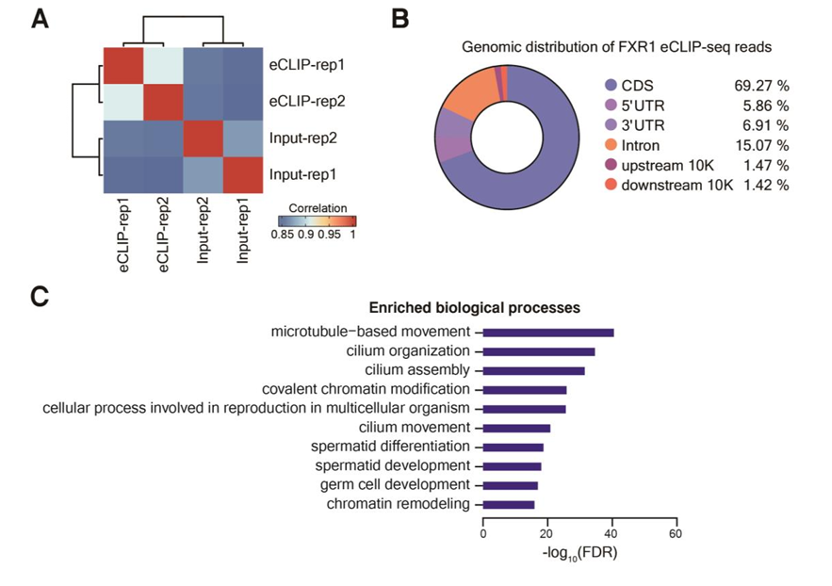
图16. FXR1与小鼠睾丸中的一大组mRNAs相关
为了验证FXR1是否与翻译因子互作、结合mRNA在后期精子细胞中翻译,接下来进行了免疫沉淀(IP)与质谱联用,如图17表示共有125种蛋白质在抗FXR1 IP颗粒中显著富集,其中包括真核生物翻译起始因子(EIF4G3)(一种支架蛋白,其组织EIF4F复合物组装到mRNA上以起始帽依赖性翻译)、核糖体亚基等等。同时发现了与FXR1结合的mRNA的翻译主要发生在后期精子细胞中。
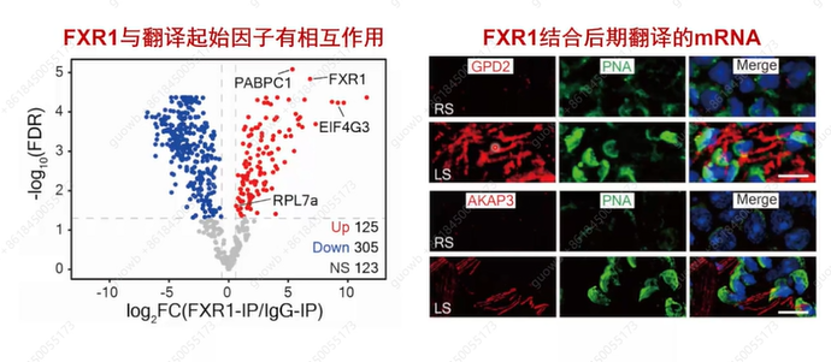
图17. FXR1与翻译因子的关系以及结合mRNA在后期精子细胞中翻译
FXR1是否激活其结合的mRNA翻译呢?实验室又构建了在生殖细胞中特异性敲除FXR1小鼠模型,发现敲除小鼠靶基因的蛋白水平会剧烈下降(图18),且小鼠出现完全雄性不育,附睾无精子(图19)。
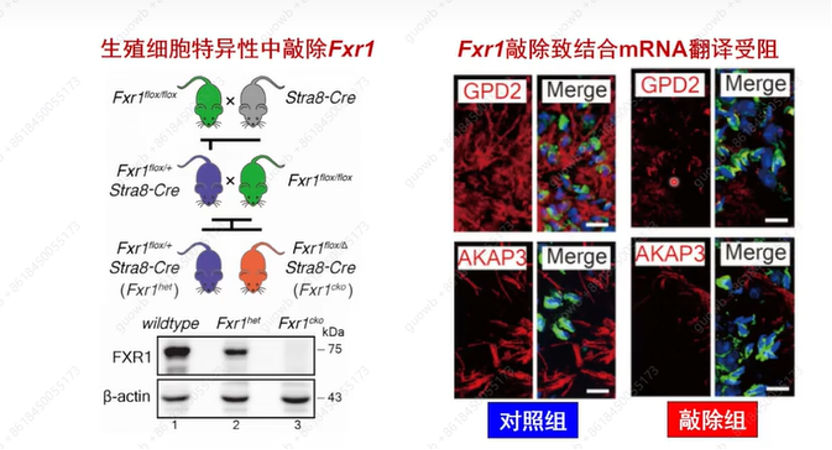
图18. FXR1基因缺失小鼠蛋白和翻译水平的变化
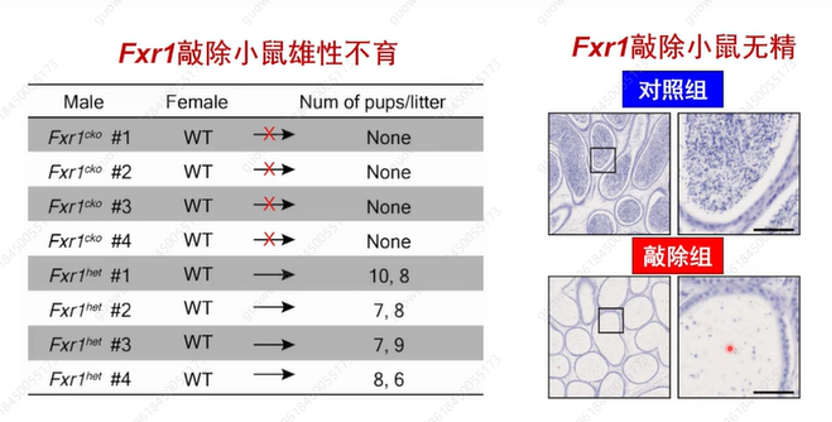
图19. FXR1基因缺失小鼠不育
FXR1是否激活后期精子细胞翻译? FXR1在后期精子细胞中呈颗粒状且附着核糖体,刘默芳教授团队研究了FXR1是否也在小鼠LS中进行相分离以形成缩合物。FXR1通过选择性剪接编码七种异构体,即FXR1a至FXR1g,并且所有这些异构体在C末端都含有IDR(内在无序序列,相分离的标志性元件)。进一步实验证明FXR1蛋白可以进行相分离,并且FXR1缩合物在体外和纤维素中显示出液体状特征。
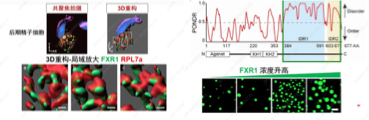
图20. FXR1在后期精子细胞中的状态
相分离是否对翻译激活重要? 将FXR1a的KH2结构域中351位的亮氨酸残基定位为相分离的必需残基。这是一个完美的点突变,FXR1aL351P突变体保持了正常的RNA结合能力,而L351P突变可能通过改变KH2结构域中Y353和Y357的疏水口袋和构象来损害FXR1相分离,回复突变又能够恢复FXR1相分离(图21)。
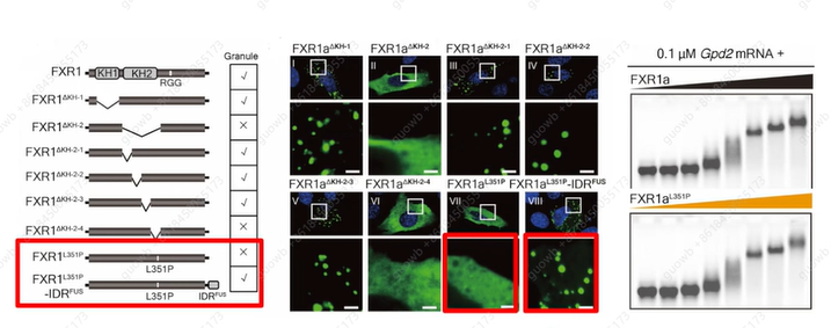
图21. FXR1及突变体结合mRNA的能力
实验室使用TRICK(通过外壳蛋白敲除翻译RNA成像)报告系统来确定FXR1颗粒是否需要翻译其靶标。NLS-PCP-GFP{与细胞核定位序列(NLS)和绿色荧光蛋白(GFP)融合的PP7外壳蛋白(PCP)}和NLS-MCP-RFP{与NLS和RFP融合的MS2外壳蛋白(MCP)}的共转染导致转染的C2C12细胞中细胞核Gpd2 mRNA的双色标记(图22,I),表明未翻译状态。蓝色荧光蛋白(BFP)标记的FXR1a的共表达产生了一部分Gpd2(FXR1的一个靶基因)进入细胞质中的FXR1a颗(蓝色)(图22,图II和图III)。FXR1a颗粒中的Gpd2 mRNA被RFP标记而不是GFP,而嘌呤霉素处理导致FXR1a颗粒中的mRNA被GFP和RFP标记。这些结果表明FXR1a将靶mRNA招募到FXR1a颗粒中以触发其翻译。
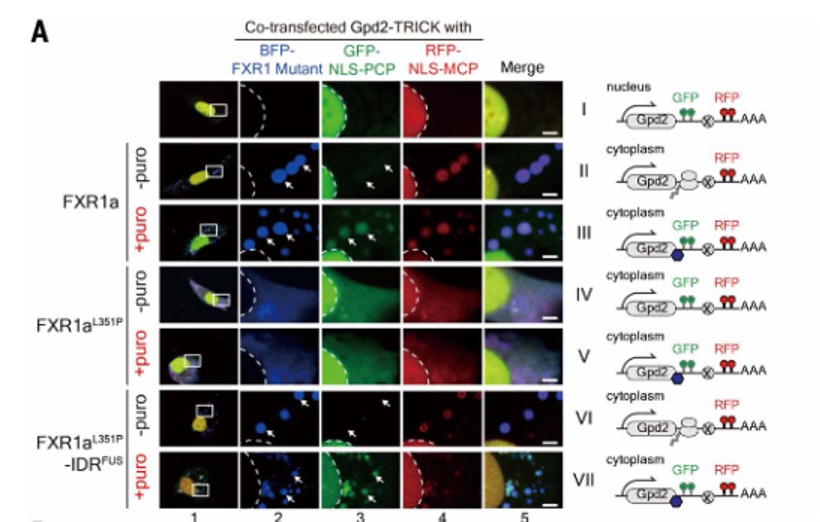
图22. 相分离对小鼠FXR1在翻译激活和精子发育中的功能至关重要
为了进一步研究阶段分离对FXR1在小鼠精子细胞翻译激活中的功能是否至关重要,构建了FXR1 -内部核糖体进入位点(IRES)-细胞色素氧化酶IVN -末端(Cyto IV)-融合增强型绿色荧光蛋白(EGFP)慢病毒载体,在Fxr1cko睾丸中异位表达野生型FXR1、FXR1L351P或FXR1L351P -IDRFUS(回复突变)。仅有野生型或它们的FXR1L351P-IDRFUS回复突变体,在Fxr1 - null LS中拯救了FXR1颗粒和靶基因的蛋白表达以及精子形成,而FXR1L351P突变体中没有靶基因的蛋白表达以及精子形成(图23)。
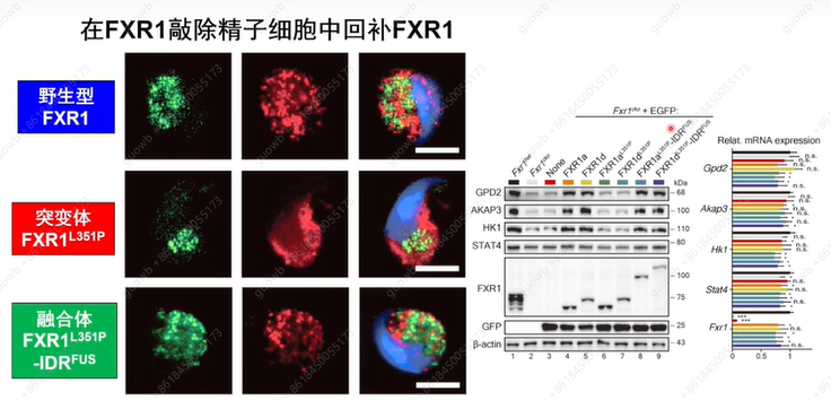
图23. 精子细胞中FXR1靶向表达的蛋白质印迹和RT-qPCR分析
构建了种系特异性Fxr1L351P敲除(称为Fxr1cki)小鼠,这些突变小鼠的附睾中几乎不存在精子,FXR1相分离对小鼠精子发育和雄性生育是必须的(图24)。
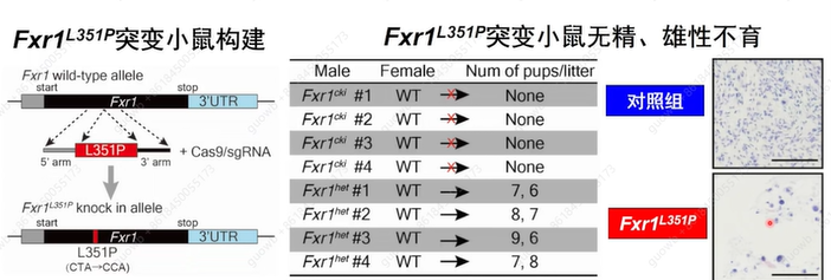
图24. L351P突变破坏了FXR1的相分离能力
最近的研究表明,生物分子凝聚物广泛存在于真核细胞中,作为非膜结合的亚细胞区室,它们可能富集蛋白质和/或核酸,从而在特定的细胞过程中实现时空控制。RNP颗粒,是RNA结合蛋白(RBPs)结合RNA组成的复合物,被认为自组织成无膜细胞器,这个过程被称为液-液相分离(LLPS),因为RBPs固有无序区域(IDRs)。在发育中的生殖细胞中,RNP颗粒被称为生殖细胞颗粒。它们主要存在于细胞质中,储存非翻译的mRNA中,是RNA调控的主要场所。在翻译惰性mRNP颗粒中也发现了FXR1,FXR1蛋白经历LLPS将mRNP颗粒与翻译机制合并,以激活精子发生过程中储存的mRNA的翻译。
除了RNP,刘默芳教授团队还关注到了两种生殖颗粒,Intermitochondrial cement(IMC)和拟染色质体(Chromatoid body,CB),IMC和CB是哺乳动物雄性生殖细胞中最典型的两种生殖颗粒。IMC可见为位于线粒体簇中的电子致密颗粒,首先出现在胎儿前精原细胞(prospermatogonia),在中粗线期精母细胞(mid-pachytene spermatocytes)中变得明显,然后随着线粒体弥散在晚粗线期精母细胞(late-pachytene spermatocytes)中逐渐解体,并在减数分裂后精子细胞阶段完全消失。相比之下,CB前体细胞在晚粗线期精母细胞中以小颗粒的形式出现,位于靠近核包膜。
MIWI蛋白表达在粗线期精母细胞中起始,并通过减数分裂后的精子细胞持续存在。MIWI最初通过与线粒体锚定的Tudor结构域蛋白TDRKH相互作用被募集到IMC,用于中粗线期精母细胞中的piRNA 加工。 piRNA负载促进了MIWI与TDRKH的脱离,促进了其从IMC的释放。这种分离使 MIWI 蛋白为精氨酸甲基化奠定了基础,随后通过其甲基化的精氨酸残基促进了其与TDRD6的结合,从而最终将其整合到CB中。 通过构建piRNA加载缺陷的 Miwi突变小鼠,该研究证明了MIWI中piRNA 加载能力的丧失阻碍了其在精子发生过程中从 IMC 到 CB 的易位。这种阻塞严重破坏了发育中的雄性生殖细胞中的MIWI稳定性,并导致小鼠的精子发生缺陷和雄性不育(图25)。
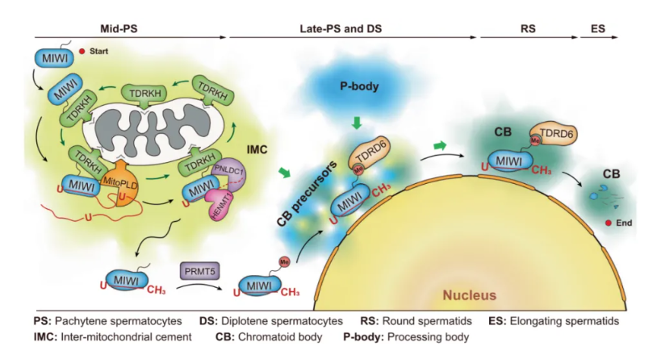
图25. 小鼠精子发生中MIWI蛋白从IMC转运到CB的精细途径模型
最后刘默芳教师总结,对于证明RNA调控对精子形成和男性生殖至关重要,主要集中在研究精子形成的4个方面:
(1)精子细胞中存储mRNA如何被激活翻译?(2)精子细胞的可变剪接调控机制?(3)组蛋白-鱼精蛋白交换如何启动?(4)精子形成前大量mRNA如何被清除?piRNA机制通路调控异常是男性不育的新病因。这一系列的研究,解答了精子发生中多个难点问题。促进了对雄性生殖规律和男性不育病因的认识。
未来的研究方向将会是在精子发生过程中的前两个阶段有丝分裂和减数分裂过程中的RNA 调控在精子发生中的新功能机制、RNA调控与精子功能及代际遗传以及RNA调控与男性生殖健康。
刘默芳教授此次会议报告已收录于Guangzhou RNA club bilibili视频网站(https://www.bilibili.com/video/BV1K64y1T7Jp/?spm_id_from=333.999.0.0)
欢迎关注Guangzhou RNA club公众号、网站(rnaclub.rnacentre.org)、twitter(@RNA_club)。
























