会议回顾
2023年4月25日,中山大学孙逸仙纪念医院黄林副研究员邀请了英国John Innes Centre丁一倞教授进行了线上学术报告“RNA structure, a ohidden regulator in living cells”。丁一倞教授于2005年上海交通大学获得学士学位;2009年John Innes Centre获得博士学位。2010-2013在美国Pennsylvania State University作博士后研究。2014至今在John Innes Centre作为group leader带领团队专注于RNA高级结构的研究。2022至今同时担任英国Babraham Institute的group leader及University of East Anglia的荣誉副教授。获得David Phillips Fellowship等多种荣誉。在顶尖杂志Nature, Genome Biology, Nucleic Acids Research以及Nature communications发表论文数十篇。
丁一倞教授课题组研究重点在确定RNA结构在基因表达的转录后调控中的作用,包括翻译,多聚腺苷酸化,RNA剪接,RNA稳定性和RNA加工;探索RNA结构如何随着环境变化而改变;与开发新的实验和分析方法来揭示RNA结构和RNA-蛋白质相互作用。
讲座内容
当我们回顾中心法则,组成核染色质的DNA具有复杂的三级结构,DNA经过转录、翻译后生成同样具有复杂结构的蛋白质。然而在教科书中,纵观整个中心法则,信使RNA(mRNA)被绘画成线状单链,但mRNA是否真的为线状结构值得我们深思。当你在试管中放入不同浓度的多种mRNA(例如不同缓冲液条件,不同mRNA长度或GC含量),会发现它们将折叠成特定的RNA二级结构(如茎环结构)。多年来,除了茎环结构,人们还发现了假节、RNA三联体与G-四链体等结构。
在过去的30年里,这些结构已经被研究与解析,但为什么仍有教科书把mRNA画成线状单链?最主要的原因是所有这些研究都是基于体外研究,因此无法确定RNA在体内是否也如此折叠,也无法知道它们相应的功能(图1)。
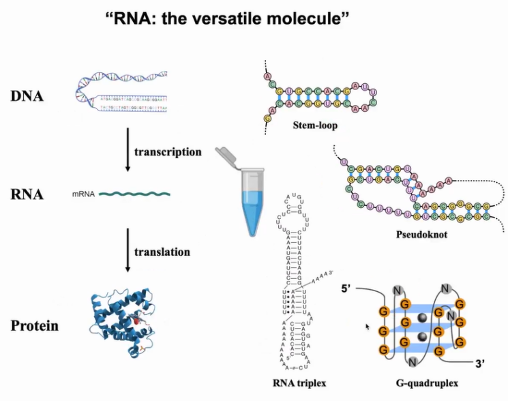
图1. RNA的体外折叠
2013年丁一倞作为博士后期间,利用化学试剂硫酸二甲酯(DMS)和SHAPE进行体内RNA结构测定。这些试剂能穿透细胞并修饰单链上的核苷酸。DMS能在环、凸起和错配等非结构化区域的沃森克里克碱基配对面甲基化腺嘌呤的N1和胞嘧啶的N3,由于甲基的阻碍,在进行逆转录时反应将在修饰的核苷酸位置停止。若得到的中止产物越多,说明这些核苷酸处于单链位置。随后可通过深度测序技术计算出化学反应活性。高化学反应活性意味着拥有更多的逆转录中止产物,表明核苷酸被修饰,该位置更倾向于单链结构。同理,逆转录中止产物越少,表明核苷酸修饰较少,该位置为双链结构的可能性就越大。SHAPE试剂含有高纯度形式的2-甲基烟酸咪唑化物(NAI),能在四种核苷酸的非结构化区域的核糖上酰化2’ -OH,同样地,修饰位点阻碍了逆转录,反应将在修饰位点停止或引入突变。通过以上技术可在大范围内捕获体内RNA结构(图2)。
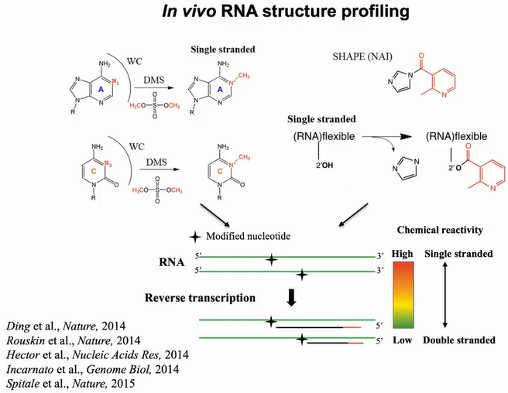
图2:体内RNA结构分析原理
再回顾到教科书重要的生物过程中,RNA聚合酶Pol II合成的新生RNA、miRNA介导的mRNA降解过程、在核糖体中进行翻译的mRNA,皆被绘画成没有高级结构的线状单链。这些RNA是否具有结构我们无从而知。由此丁一倞教授通过探究这些RNA的结构功能来验证体内RNA的状态(图3)。
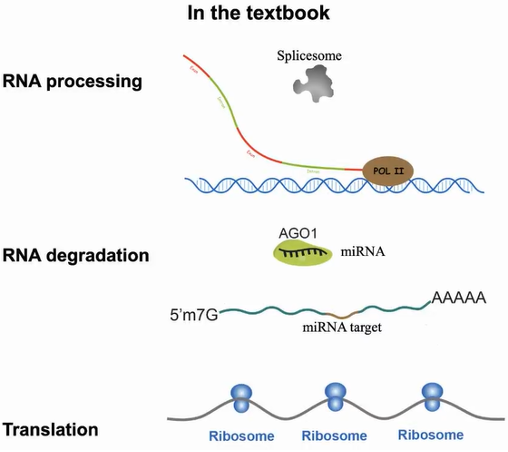
图3:mRNA的生成、降解和翻译过程
首先探讨的问题是剪接体是如何识别剪接位点的。Pol II转录出的新生RNA中,剪接位点的5’端和3’端分别有很多GU、AG序列模体,然而只有某个特定的GU、AG能作为真正的剪接位点,猜测其中会有结构模体参与剪接位点的识别(图4)。
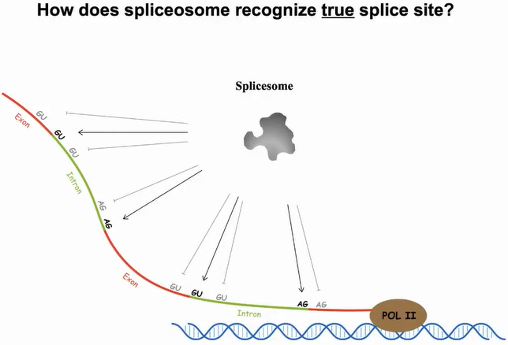
图4:剪接体对剪接位点的识别
为了验证猜测,丁一倞教授通过捕获剪接前pre-mRNA的结构,分析什么样的结构影响剪接过程。作者用SHAPE试剂处理植物,试剂穿透细胞修饰单链的RNA,随后分离并裂解细胞核富集pre-mRNA,再经过深度测序和metagene分析得到pre-mRNA结构文库及其结构信息。依据结构将这些RNA分为两组,一组为pre-mRNA将发生剪接反应切除内含子生成成熟的mRNA;另一组的pre-mRNA不发生剪接反应。通过比较两组pre-mRNA的结构信息,发现了三处位点有显著差异,尤其是内含子5’端的5’剪接位点 (5'ss)上游的两个核苷酸,当它们处于单链时可发生剪接反应。当有两个可供选择的5’ss时,其上游具有单链结构的双核苷酸位点将作为主要的剪接位点(图5)。
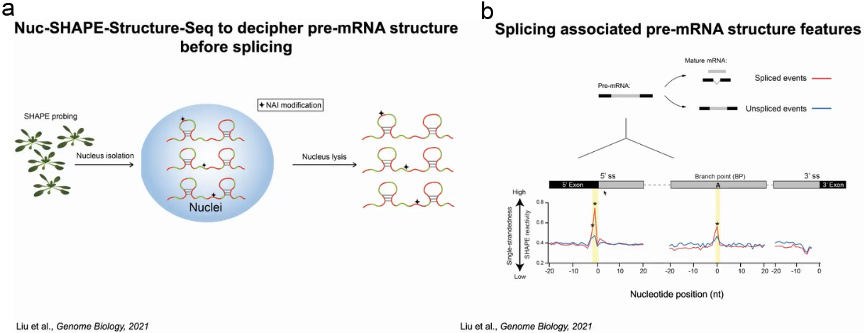
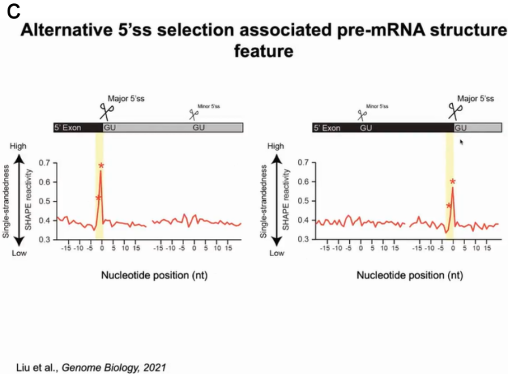
图5:pre-mRNA中5'ss上游的二级结构特征与剪接位点选择有关
作者选择成功剪接的AT5G56870的第一个外显子-内含子-外显子区域作为5’ss上游包含双核苷酸单链RNA结构特征的pre- mRNA的代表性例子。通过SHAPE技术确定-1,-2位为单链结构,随后在烟草中进行功能验证。原序列在烟草中可成功发生剪接。为了避免破坏5’ss和U1 snRNA之间的碱基配对而影响剪接过程,在U1 snRNA结合位点(红色虚框)的上游插入短序列(蓝色),使其形成稳定的发夹结构后将不再发生剪接反应。在插入序列的不同位置引入一系列突变,以改变不同核苷酸的碱基配对状态,发现只有改变-1,-2位点的碱基配对状态才对剪接过程产生影响,说明5’ss上游的双核苷酸单链RNA结构足以调节剪接。由此我们可知,若5’ss上游形成了碱基配对将阻碍剪接反应的发生,若5’ss上游为单链结构,剪接反应将顺利进行。证明了新生RNA确实形成了对剪接反应至关重要的特定结构,对传统教科书上描绘的RNA加工过程进行了纠正更新(图6)。
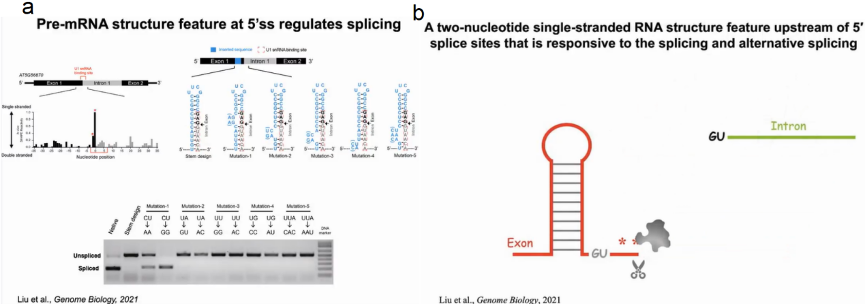

图6:5'ss二级结构特征调控剪接反应
随后关注到miRNA介导的mRNA降解过程,在该过程中AGO1蛋白与miRNA结合后定位于mRNA的靶区域形成碱基配对。在植物系统中miRNA与靶区域形成21对碱基配对,在序列中可找出成千上万的完全配对区域,然而其中假阳性却高达70%。为了确定靶标mRNA是否通过形成特定结构来调控此过程,作者通过SHAPE probing去除切割后的RNA,保留未切割的mRNA,从而探究什么样的结构影响切割过程。经过647例有效数据的验证,作者发现miRNA结合靶点确实形成了特定的空间结构,从而防止非特异的降解发生(图7)。
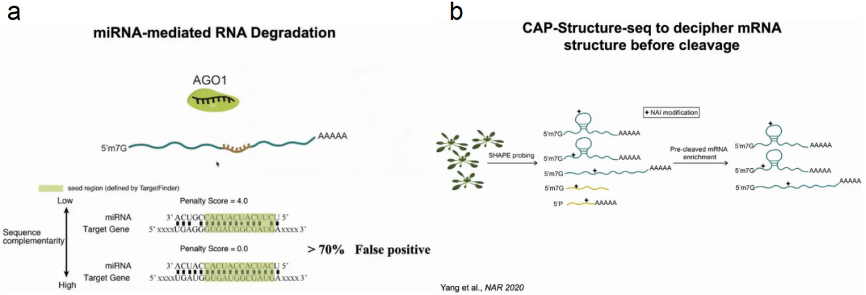
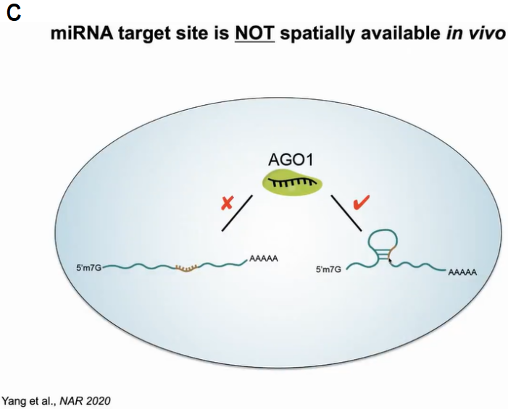
图7:mRNA结构影响miRNA介导的降解过程
作者对miRNA介导的mRNA降解过程绘制了能量景观图,该过程需克服靶结合(△Gopen)和裂解催化(△Gcutting)能垒。其中AGO1对靶位点的可及性难易程度是该反应的限速步骤,克服该能垒mRNA的降解可顺利进行。对647例有效数据计算切割效率,△Gopen与切割效率成负相关,然而△Gcutting与切割效率没有显著相关。相比植物系统,动物系统中AGO2只需和靶位点形成7-8对碱基配对,△Gopen相对小很多。由于△Gopen比△Gcutting小,在动物系统中AGO2更容易切割靶RNA(图8)。
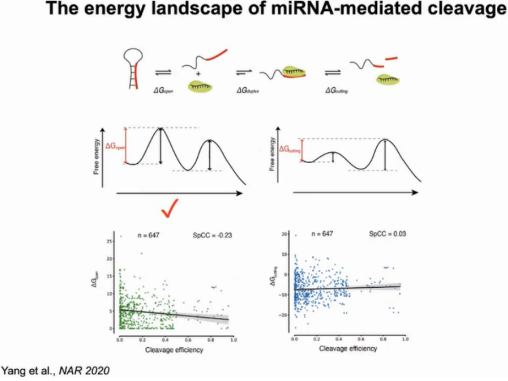
图8:miRNA介导降解过程的能量景观图
在揭示了靶位点结构在体内影响切割后,作者随后研究了靶位点侧翼区域的结构是否与miRNA切割有关。作者将RNA靶点分为非切割(零CE)和切割(阳性CE)组来评估RNA二级结构,发现与非切割组相比,切割组靶位点下游+1和+2 nt处的SHAPE反应性更高,表明这两个核苷酸处于单链状态从而发生切割反应。作者将这一结构特征命名为靶邻近核苷酸基序(TAM)。
为了探索TAM在miRNA介导切割中的功能作用,作者设计了一个包含20nt的miRNA156结合靶点和稳定结构模块的结构分析实验。作者将靶点与G-四链体或茎环结构连接起来,为了保持TAM的单链性,作者在靶位点和设计的结构模块之间插入了两个腺嘌呤(AA),结果发现有TAM的靶基因mRNA水平明显低于没有TAM的靶基因。这表明存在TAM时导致更高的裂解(图9)。
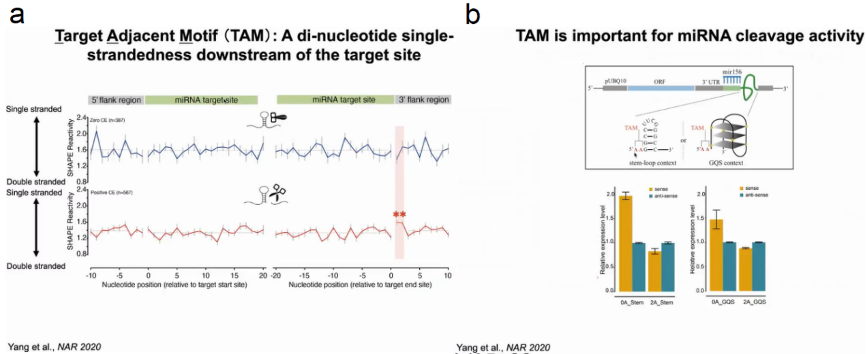
图9:TAM在miRNA介导切割中的功能作用
为了进一步证实TAM的存在促进了靶蛋白的裂解,作者使用纯化的AGO蛋白进行体外裂解实验。结果显示只有在TAM存在时目标RNA才被切割,证明TAM对miRNA诱导的沉默复合物(miRISCs)核酸酶活性至关重要。为了检测TAM影响靶结合的可能因素,作者使用有切割缺陷的AGO1突变体进行体内结合实验,发现无论TAM是否存在,AGO1都能够以相同的结合亲和力结合目标RNA,证明TAM促进miRISC的裂解活性,但不影响其与靶标结合(图10)。
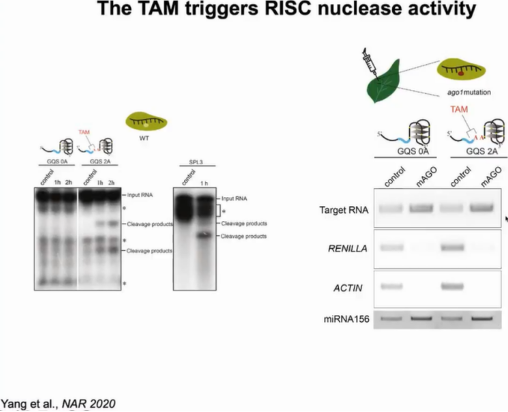
图10:TAM激活RISC活性
因此在miRNA介导的mRNA切割模型中,首先要克服打开mRNA靶点碱基配对的能垒(1),miRNA与靶点结合为能量释放的过程(2),若mRNA上存在TAM,则折叠成可裂解的构象,此时需要克服的能垒较低(3),若mRNA上不存在TAM,则折叠成裂解不相容构象,此时能垒高,不引发切割反应(4)(图11)。
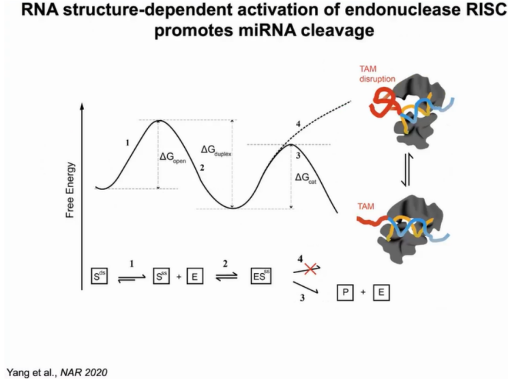
图11:miRNA介导的mRNA切割模型
miRNA172的靶向基因APETALA2,是植物系统中著名的基因之一,主要调控花卉的发育过程。由于miRNA172结合位点下游+1,+2形成碱基配对,APETALA2不发生切割反应。当通过碱基突变破坏此处的配对,形成单链的TAM序列,切割即可发生(图12)。
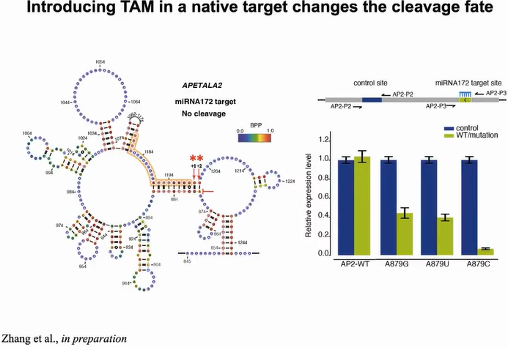
图12:TAM触发miRNA介导切割
为了探究APETALA2对植物产生的影响。丁一倞教授课题组博士后产生转基因品系。野生型的哥伦比亚植物具有白色花瓣,敲除APETALA2基因植物将失去白色花瓣(ap2-5),回复突变后将恢复白色花瓣(WT-11/ap2-5)。当把+2的A突变为A(A879G-1)/G(A879U-1)/C(A879C-1)时,由于打破碱基配对而形成单链的TAM,引发APETALA2切割,效果与敲除APETALA2基因植株相当(图13)。
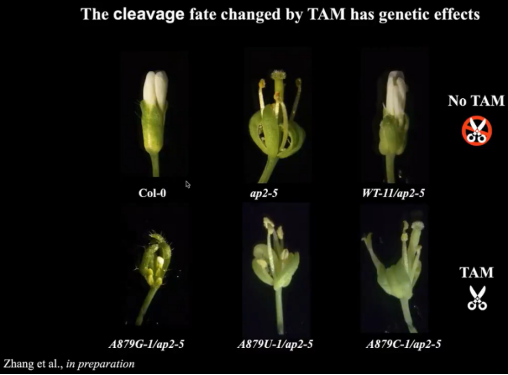
图13:TAM触发降解对植物产生的影响
RNA G -四链体(RG4)二级结构是由核酸中富含鸟嘌呤(G)的序列形成的,四个鸟嘌呤碱基可以通过Hoogsteen氢键结合形成一个称为鸟嘌呤四聚体的方形平面结构,两个或更多的鸟嘌呤四聚体可以堆叠在一起形成G4。钾离子可以稳定G4结构,而锂离子使G4结构不稳定。在人体中存在许多G4结构。过去30多年来,人们不知道G4是否存在于体内,其如何行使功能也不为人知(图14)。
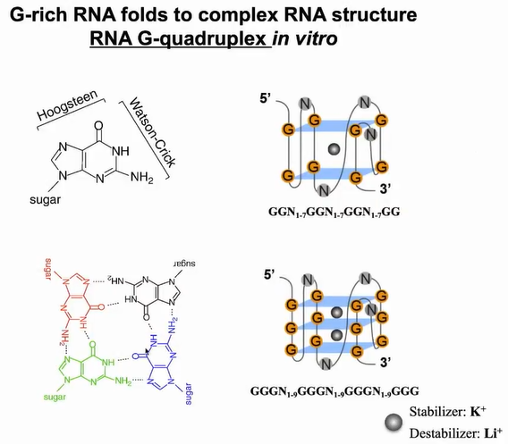
图14:rG4结构
为了验证在体外具有折叠潜力的富含G的区域是否能够在体内折叠成RG4s。作者采用NAI的选择性2 ' -羟基酰化与锂离子引物延伸(SHALiPE)结合并进行高通量测序(SHALiPE- seq)。SHALiPE-Seq是基于2-甲基烟酸咪唑烷(NAI)对折叠RG4s中G区的最后一个G的优先修饰,强修饰导致逆转录在修饰的G处停滞,可通过深度测序检测到:在SHALiPE-Seq文库中,鸟嘌呤的折叠态(含K+)的read计数更高且分布不均匀,而未折叠态(含Li+)的read计数分布均匀。该方法可以通过特殊的reads数来判断富G区域的折叠状态和未展开状态。
首先在离体植物中分别建立了K+(折叠态)或Li+(未折叠态)存在时富G区折叠态和未折叠态的标准SHALiPE谱。经过比较分析,体内SHALiPE图谱在与体外K+(折叠态)存在的情况下SHALiPE图谱相似,证明在植物体内富含G区域在体内折叠成rG4结构(图15)。
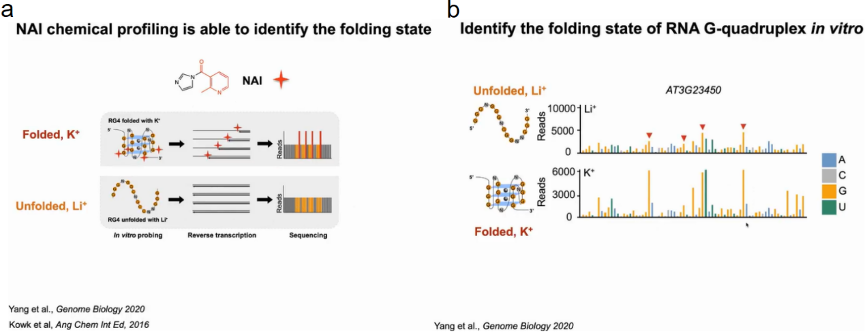
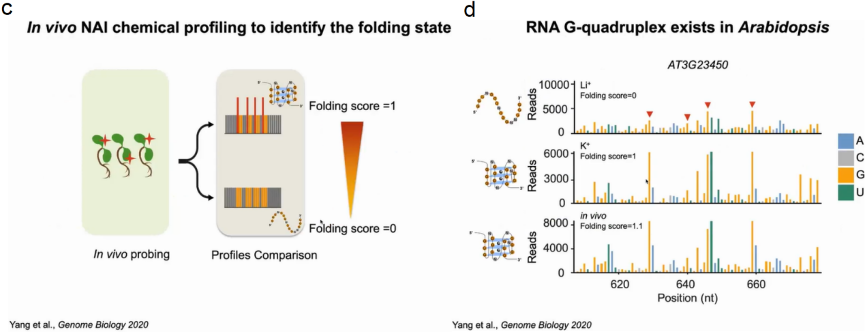
图15:SHALiPE-seq分析原理与流程
为了进一步量化体内折叠状态,作者计算了折叠分数。在拟南芥富含G的区域中,体内折叠分数大部分超过0(未折叠态),集中在1附近(折叠态),中位数为0.755,表明RG4s在拟南芥中形成。同样在富含GC碱基的水稻中,体内折叠分数也集中在1附近(折叠态),中位数为0.938,表明RG4s在水稻中的折叠状态。由此可知RNA G-四链体结构在植物体内普遍存在(图16)。
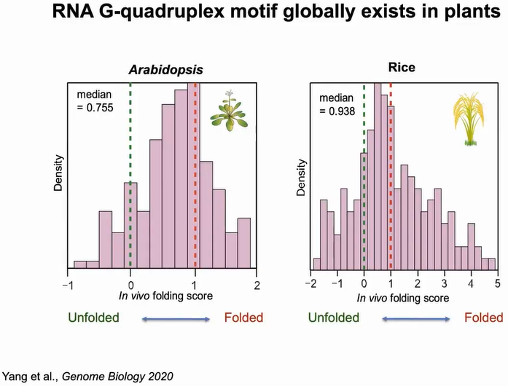
图16:拟南芥和水稻体内折叠分数
随后作者研究RG4的功能作用。拟南芥基因HIRD11的3'UTR中含有RG4。与野生型相比(Col-0),突变体(hird11-1)主根较短,通过将含有野生型RG4序列(wtRG4)的HIRD11补充到突变体中,纠正了HIRD11 -1短主根的表型,表明HIRD11促进植物的生长。当将wtRG4中4个G突变为A(mutRG4),破坏了RG4的折叠,再与hird11-1突变体互补时,mutRG4植株的主根长度明显长于wtRG4植株(图17)。
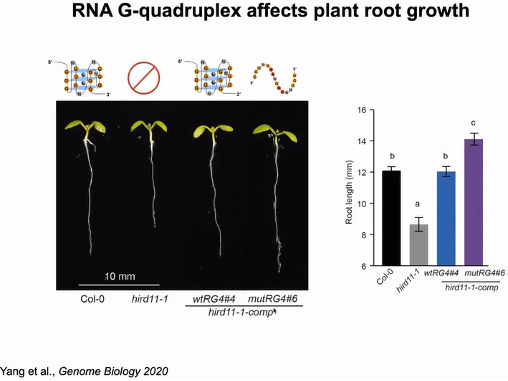
图17:RG4影响植物主根长度
随后评估RG4折叠是否影响HIRD11的基因表达。首先比较HIRD11在wtRG4和mutRG4植物中的mRNA丰度,发现这两种植物之间的mRNA丰度没有显著差异。但mutRG4植株中多聚核糖体相关的HIRD11 mRNA远高于wtRG4植株,表明mutRG4植株中HIRD11的翻译水平更高。证明RG4通过抑制HIRD11的翻译来调节植物的生长(图18)。
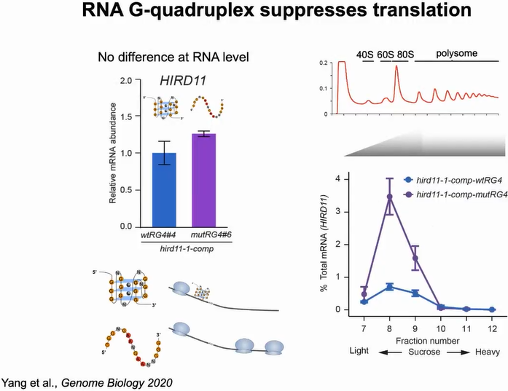
图18:RG4抑制HIRD11的翻译
有研究报导在老鼠和酵母体内RG4成未折叠态。通过GO分析与生存环境的对比,作者认为也许是由于植物生存在温度相对较低的环境下。因此作者想验证温度是否影响RG4的形成。拟南芥幼苗在22℃或4℃处理2h后使用SHALiPE-seq测定RG4在体内折叠状态并生成SHALiPE-Seq文库。通过与标准SHALiPE谱对比,22℃时拟南芥的折叠分数与Li+存在下未折叠的体外基准相似,而4℃时拟南芥的折叠分数与K+存在下的折叠态相似。随后作者利用能够检测细胞RG4的BG4抗体,通过免疫荧光检测在拟南芥细胞中观察RG4的形成。结果显示与22℃的正常温度相比,4℃的低温条件下细胞质中BG4聚集显著增强,表明低温促进了RG4在植物细胞中的折叠。当冷处理植物返回22℃处理2h时,BG4信号恢复到22℃正常温度时相似的水平。体内结构分析和免疫荧光检测表明,植物在寒冷条件下,RG4的形成增加(图19)。
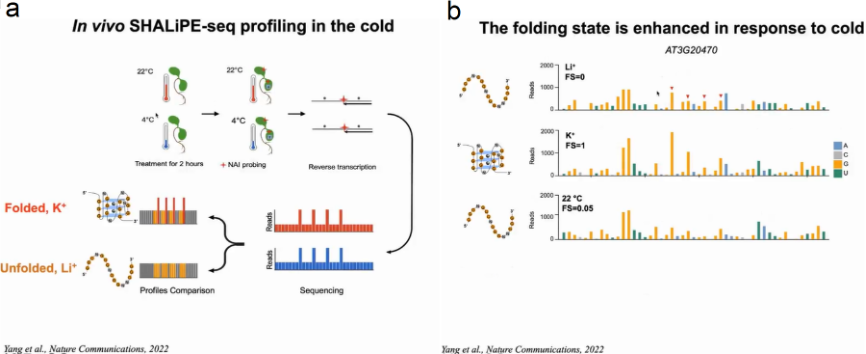
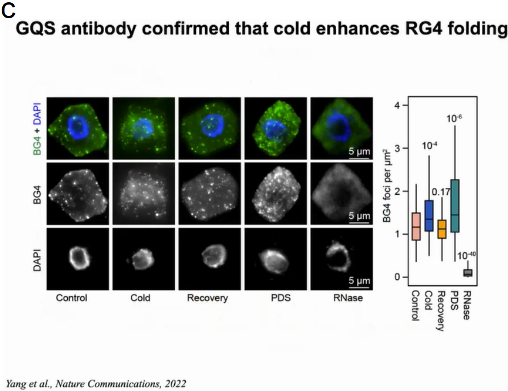
图19:拟南芥体内结构分析和免疫荧光检测
大量研究表明RG4可作为翻译抑制因子。因此,作者评估了冷响应性RG4s是否在寒冷条件下抑制翻译。通过比较含有冷响应RG4s的基因在4℃和22℃下的翻译效率(TEs),发现4℃和22℃的TEs没有明显差异,表明冷响应性RG4不太可能会抑制翻译。
基于先前的研究表明,3’UTR中的结构元件可能调节mRNA的稳定性,因此作者假设冷响应RG4s可能影响mRNA的稳定性。作者使用转录抑制实验测量了拟南芥转录组在22℃和4℃下的RNA稳定性。在转录停止后mRNA丰度下降的速度反映了RNA的稳定性,结果显示与22℃相比,4℃时mRNA丰度的下降速度普遍较慢,其中在3’UTR中具有冷响应RG4s的转录本减缓RNA丰度下降效果最显著。
随后作者想验证RG4S是否会影响mRNA在寒冷条件下的稳定性,作者构建报告基因FLUC分别与包含野生型冷应答RG4 (wtRG4)或突变RG4 (mutRG4)的CORG1的3’UTR融合。随后在4℃和22℃下进行转录抑制实验,结果显示含有mutRG4的CORG1 3’UTR的FLUC mRNA在4℃时比含i有wtRG4的FLUC mRNA降解得快得多,而在22℃时两者没有明显差异,表明这种冷响应性RG4增强了mRNA在寒冷条件下的稳定性。
在此前提下作者将含有wtRG4或mutRG4 3’UTR的CORG1的拟南芥基因组DNA重新引入到corg1-1基因敲除植株中。在22℃时,corg1-1的根长与野生型Col-0相似;4℃时,corg1-1的根长明显长于Col-0,对冷刺激不敏感。当corg1-1与mutRG4-CORG1互补时,在4℃时根长度明显长于wtRG4-CORG1互补植株,而在22℃时则无显著差异,表明mutRG4-CORG1植物对寒冷的感知能力受损(图20)。
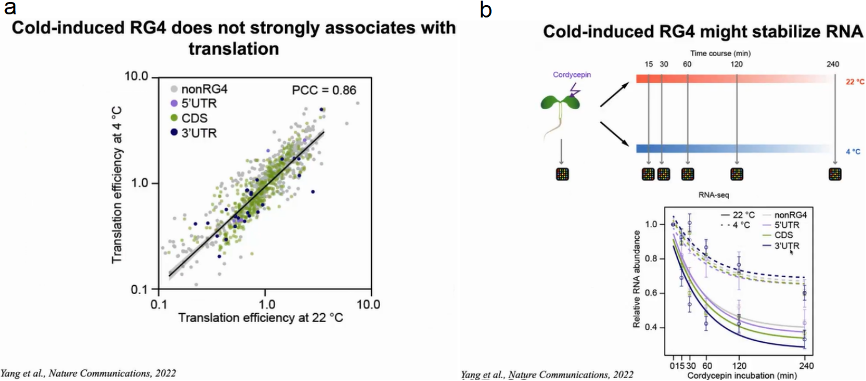
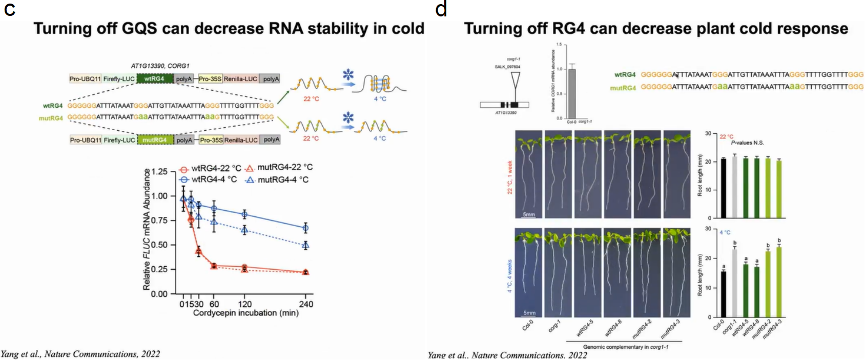
图20:4℃和22℃下冷响应RG4对植物生长的影响
作者系统地分析了1000种植物转录组的核苷酸组成及其相应的栖息地。发现在寒冷气候下生长的植物具有鸟嘌呤(G)富集的转录组,且易于形成RG4结构。
若植物的3’UTR处于未折叠状态,转录的mRNA更容易降解,则植物生长。若植物的3’UTR处于折叠态,RNA水平更稳定,植物体型更小以应对寒冷压力。丁一倞教授课题组在不断努力更新教科书带给我们的刻板印象,带领大家更多地了解结构在不同生物过程中的功能作用(图21)。
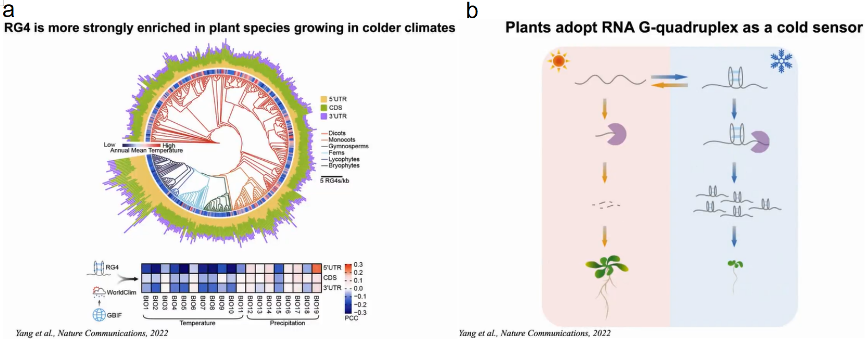
图21:植物RG4作为冷传感器
最后,丁一倞教授向我们分享了2022年发表在Nature上的研究工作。长链非编码RNA(lncRNA)在生物体生长发育及疾病产生等过程中发挥重要调控作用。近些年来,越来越多的研究表明lncRNA的二级结构可以顺式或反式作用来调控染色质的状态进而影响基因的表达。细胞内同一个基因的转录本,包括lncRNA,在加工过程中会产生不同的可变剪切产物;另外,即便是序列相同的可变剪切产物,在体内也会形成不同的RNA结构构象,因此,细胞内的lncRNA在序列和二级结构上存在高度的异质性。这些异质性导致研究人员无法准确区分lncRNA不同的可变剪切产物的功能(图22)。
图22:RNA结构高度动态变化
在拟南芥开花过程中,一系列统称为
COOLAIR的反义lncRNA ,可以通过调控关键开花抑制基因
FLC的表达而影响植物的开花时间。
COOLAIR 在体内存在丰富的加工形式,根据3’端加工情况可以分为两类:一类是比较短的proximal
COOLAIRs,也称为Class I
COOLAIRs;另外一类是比较长的distal
COOLAIR,或称为Class II
COOLAIRs,其中每一类都存在不同的可变剪切产物。之前的研究表明,不同的
COOLAIR可变剪切产物在温暖和寒冷的条件下,以不同的调控机制影响
FLC基因的转录(图23)。
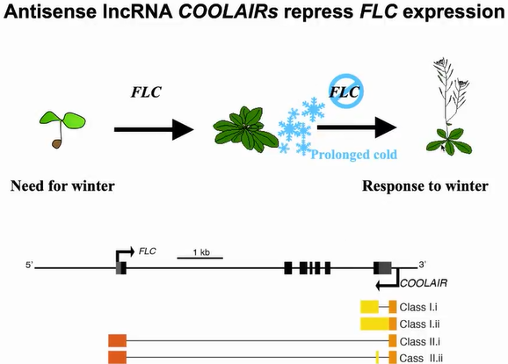
图23:COOLAIR抑制FLC的表达
为了解析不同
COOLAIR 可变剪切体的RNA二级结构在体内可能存在的功能,丁一倞课题组开发了一种基于单分子测序的体内单分子RNA二级结构解析的方法,称为smStructure-seq(single molecule-based RNA structure sequencing)。基于该方法,研究人员可以同时获得体内同一个基因不同可变剪切产物的单个RNA分子的结构信息。同时,研究人员开发了一个对应smStructure-seq的分析方法,称为DaVinci(Determination of the Variation of RNA structure conformation),可以准确拆分序列相同的RNA分子的构象组成(图24)。
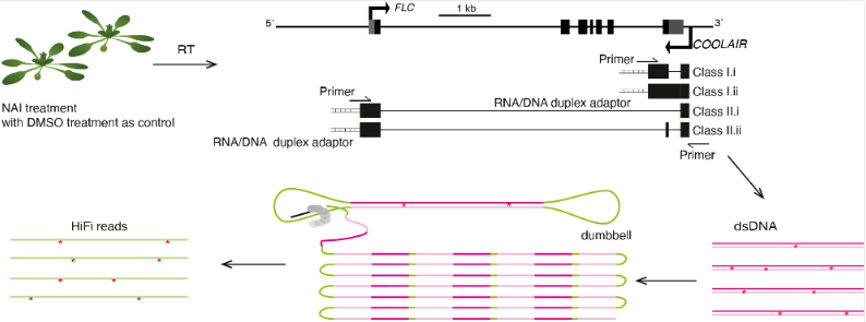
图24:smStructure-seq方法的流程
研究人员最终发现不同的
COOLAIR可变剪切产物具有不同的、处于动态变化的RNA二级结构。丰度最高的distal
COOALIR的可变剪切产物 Class II.i,在温暖的条件下存在三种不同的构象,且受低温诱导,其中的两种构象比例发生变化,同时有一种新的构象产生。
COOLAIR RNA 分子结构的多样化及其对温度变化的响应,可能反映了其参与的转录调控过程的复杂性(图25)。
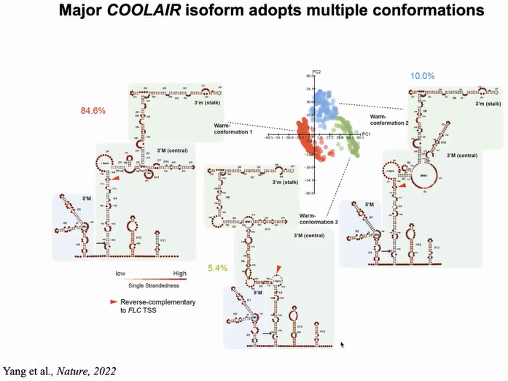
图25:COOLAIR ClassII.ii在温暖条件下存在三种不同的构象
通过比较不同构象之间的差别,研究人员发现了一个COOLAIR构象高度可变区域,且该区域与
FLC mRNA转录起始位点(TSS)所在区域反向互补。研究人员通过遗传设计所获得的改变该区域结构的突变植株具有与野生型不同的
FLC表达水平和开花时间,证明
COOLAIR RNA的结构对其发挥功能的重要性。为了进一步阐明
COOLAIR二级结构调控
FLC表达的可能机理,研究人员通过ChIRP实验比较了野生型和突变体中
COOLAIR对FLC位点染色质的结合能力,发现早花的突变体中,开放的高度可变区域使得
COOLAIR具有更强的染色质结合能力,从而导致
FLC表达下调。这与对酵母和人的研究发现一致,lncRNA在染色质上结合可以抑制基因的转录活性(图26)。
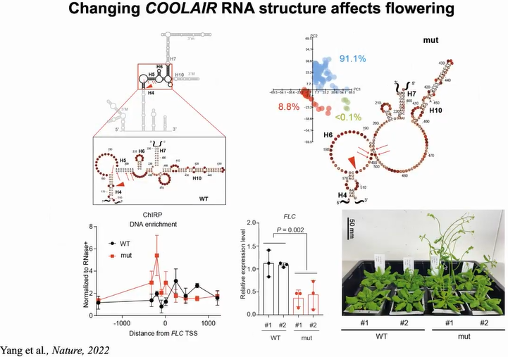
图26:COOLAIR RNA结构和功能的关系
Yiliang Ding教授此次会议报告已收录Guangzhou RNA club bilibili视频网站(https://www.bilibili.com/video/BV1bP411Q7Mr/?spm_id_from=333.999.0.0)
欢迎关注Guangzhou RNA club公众号、网站(rnaclub.rnacentre.org)、twitter(@RNA_club)。
Thanks to the International RNA Society, 表观生物, BENAGEN, and 德先生物 for their sponsorship support!































